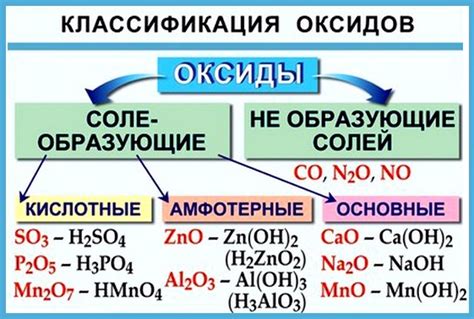
Кислотные оксиды - это вещества, содержащие кислород и элементы приземной группы периодической системы, которые проявляют кислотные свойства при контакте с водой или щелочью. Щелочи, или основания, в свою очередь, являются химическими соединениями, способными образовывать соляные кислоты при взаимодействии с кислотами или кислотными оксидами.
Взаимодействие кислотных оксидов с щелочью происходит посредством реакции нейтрализации. При этом кислотный оксид и щелочь образуют соль и воду. В результате реакции происходит перераспределение ионов, что приводит к образованию молекулярных соединений, не имеющих кислотных или щелочных свойств.
Важно отметить, что процесс взаимодействия кислотных оксидов с щелочью является эндотермическим - сопровождается поглощением тепла. Это можно наблюдать при проведении реакции в параллельных сосудах, где один сосуд нагревается, а второй охлаждается. Кроме того, реакция нейтрализации кислотных оксидов с щелочью сопровождается выделением газов, что может привести к образованию пузырьков в растворе.
Свойства кислотных оксидов
Основные свойства кислотных оксидов можно охарактеризовать следующим образом:
1. Кислотность. Как уже отмечено, кислотные оксиды проявляют кислотные свойства и реагируют с веществами щелочной природы, образуя соли.
2. Проводимость электричества. Кислотные оксиды способны проводить электрический ток в расплавленном состоянии или в растворах.
3. Коррозионная активность. Кислотные оксиды обычно обладают высокой активностью, приводя к коррозии металлов и других материалов.
4. Окислительные свойства. Некоторые кислотные оксиды могут проявлять окислительные свойства, что означает их способность окислять другие соединения.
5. Химическая реактивность. Кислотные оксиды химически активны и способны образовывать различные соединения при реакции с другими веществами.
6. Физические свойства. Кислотные оксиды, в зависимости от своего состава и структуры, могут обладать различными физическими свойствами, такими как цвет, текстура, плотность и т.д.
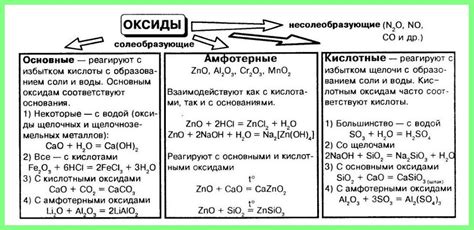
Кислотные оксиды: определение и классификация
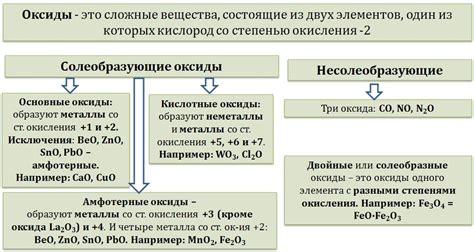
Классификация кислотных оксидов основана на природе неметалла, содержащегося в соединении:
- Единичные кислотные оксиды содержат один неметалл, например, SO2, NO, СО2.
- Многоатомные кислотные оксиды содержат несколько неметаллов, например, SO3, NO2, N2O5.
Кроме того, кислотные оксиды могут быть классифицированы в зависимости от степени окисления неметаллического элемента:
- Оксиды с максимальной степенью окисления представляют собой стабильные соединения, например, SO3, CO2.
- Оксиды с меньшей степенью окисления могут быть нестабильными и могут легко вступать в реакцию с другими веществами, например, NO, CO.
Все кислотные оксиды являются химически активными соединениями и могут быть использованы в различных процессах и реакциях.
Реакция кислотных оксидов с водой
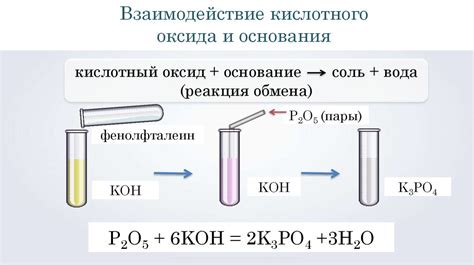
Кислотные оксиды, также известные как оксиды не металлов, могут реагировать с водой, образуя кислоты. Во время реакции происходит образование водорода и образования кислотного раствора. Процесс реакции оксидов не металлов с водой может быть описан с помощью следующего уравнения:
Оксид не металла + вода → кислота
Например, рассмотрим реакцию диоксида углерода (CO2) с водой:
CO2 + H2O → H2CO3
Реакция диоксида углерода с водой приводит к образованию угольной кислоты (H2CO3), которая является слабой кислотой.
Другой пример реакции - реакция азотного оксида (NO) с водой:
NO + H2O → HNO2
В результате этой реакции образуется азотистая кислота (HNO2).
Реакции кислотных оксидов с водой важны для химической промышленности и окружающей среды. Некоторые кислотные оксиды, например, оксиды серы и азота, могут растворяться в атмосферной влаге и образовывать кислотные осадки, что может быть вредным для живых организмов и окружающей среды.
Физические свойства кислотных оксидов
Одним из основных физических свойств кислотных оксидов является их кристаллическая структура. Часто кислотные оксиды образуют кристаллы, в которых атомы металла и кислорода располагаются в определенном порядке. Кристаллическая структура влияет на многие свойства оксидов, такие как плотность, температура плавления и твердотельные свойства.
В зависимости от своей структуры и химического состава, кислотные оксиды обладают различными физическими свойствами. Некоторые из них являются твердыми веществами с высокой температурой плавления, другие - газами или жидкостями при комнатной температуре.
Кислотные оксиды могут быть электролитами, то есть, способны проводить электрический ток в растворе или расплаве. Это объясняется наличием ионов в их структуре, которые могут перемещаться под воздействием электрического поля. Такие оксиды обладают свойствами кислот и могут реагировать с водой, образуя кислоты.
Также стоит отметить, что многие кислотные оксиды обладают высокой растворимостью в воде. Это позволяет им легко диссоциироваться и образовывать ионы при растворении. Растворы кислотных оксидов обычно обладают кислыми свойствами и способны реагировать с основаниями, образуя соли и воду.
Таким образом, физические свойства кислотных оксидов включают в себя структуру, температуру плавления, твердотельные свойства, электролитическую проводимость и растворимость в воде. Эти свойства определяют их способность к взаимодействию с щелочью и другими веществами в химических реакциях.
Химические свойства кислотных оксидов
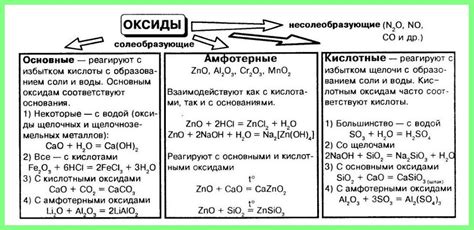
Кислотные свойства: Кислотные оксиды обладают способностью образовывать кислоты при реакции с водой. Это связано с тем, что они содержат электроотрицательные элементы, которые посредством образования оксоанионов (кислородных ионов) обеспечивают кислотное поведение. Например, диоксид серы (SO2) реагирует с водой и образует сульфитную кислоту (H2SO3).
Окисляющие свойства: Большинство кислотных оксидов являются окислителями, то есть они способны окислять другие вещества. Одним из примеров такого окисления является окисление сероводорода (H2S) двуокисью марганца (MnO2) в серу (S) и воду (H2O).
Реакция с щелочью: Кислотные оксиды реагируют с щелочными оксидами, образуя соли и воду. Это происходит при образовании кислотных оксоанионов и гидроксид-ионов. Например, оксид серы (SO2) реагирует с оксидом кальция (CaO) и образует сульфат кальция (CaSO3) и воду.
Амфотерные свойства: Некоторые кислотные оксиды обладают амфотерными свойствами, то есть они могут проявлять как кислотные, так и щелочные свойства. Например, оксид цинка (ZnO) реагирует как с кислотами, образуя соли, так и с щелочами, формируя гидроксид цинка (Zn(OH)2).
Таким образом, кислотные оксиды обладают различными химическими свойствами, которые определяют их активность и роль в химических реакциях.
Применение кислотных оксидов

Одним из главных применений кислотных оксидов является их использование в производстве кислот. Кислотные оксиды часто выступают в роли прекурсоров для синтеза различных кислот, например, серной, азотной, фосфорной кислоты и других.
Кислотные оксиды также находят применение в процессе нейтрализации щелочных растворов. При взаимодействии с щелочью они образуют соли и воду. Нейтрализация кислотных оксидов является одним из способов регулирования pH-уровня раствора.
Кроме того, кислотные оксиды широко используются в качестве катализаторов при проведении химических реакций. Они способны активировать реагенты, ускоряя химические процессы и повышая их эффективность.
Также кислотные оксиды находят применение в производстве электроники и материалов с особыми свойствами. Благодаря своей кислотной природе они способны взаимодействовать с другими материалами, что позволяет создавать новые соединения с желаемыми свойствами.