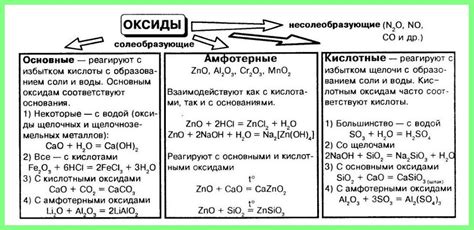
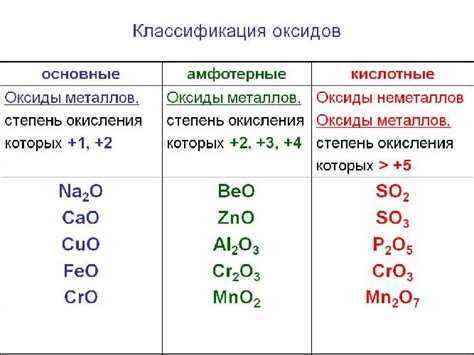
В химии оксиды являются одним из основных классов соединений, которые образуются при соединении различных элементов с кислородом. В зависимости от характера их химической реакции с водой, оксиды могут быть разделены на две группы - кислотные (кислоты) и основные (щелочи).
Кислотные оксиды, также известные как ангидриды кислот, образуются при соединении неметалла с кислородом. Они обладают кислотными свойствами и могут реагировать с водой, образуя соответствующую кислоту. Например, диоксид серы (SO2) реагирует с водой, образуя сернистую кислоту (H2SO3):
SO2 + H2O → H2SO3
Также, кислотные оксиды могут взаимодействовать с основными оксидами (основаниями), образуя соли и воду. Например, реакция между оксидом кальция (CaO) и диоксидом углерода (CO2) приводит к образованию карбоната кальция (CaCO3):
CaO + CO2 → CaCO3
Основные (амфотерные) оксиды, в свою очередь, образуются при соединении металла с кислородом. Они способны проявлять как основные, так и кислотные свойства. Например, оксид алюминия (Al2O3) может взаимодействовать как с кислотами, образуя соли, так и с основаниями:
Al2O3 + 6HCl → 2AlCl3 + 3H2O (реакция с кислотой)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (реакция с основанием)
Таким образом, реакция и взаимодействие амфотерных и кислотных оксидов являются важными процессами в химии, определяющими свойства многих соединений и их роль в различных химических реакциях.
Определение и свойства амфотерных оксидов

Основные свойства амфотерных оксидов включают:
- Реакция с кислотами: Амфотерные оксиды могут реагировать с кислотами, образуя соли и воду. В этом случае, оксид выступает в роли основы и отдает свободные анионы для реакции с протонами.
- Реакция с основаниями: Амфотерные оксиды также могут реагировать с основаниями, образуя соли и воду. В этом случае, оксид выступает в роли кислоты и принимает протоны от основания для образования соли.
- Реакция с водой: Амфотерные оксиды могут реагировать с водой, образуя кислоты и основания. В этом случае, оксид гидратируется в присутствии воды и может проявлять как кислотные, так и основные свойства.
- Реакция с другими оксидами: Амфотерные оксиды могут реагировать с другими оксидами, образуя соли и вещества совершенно новыми свойствами. Это позволяет им участвовать в различных химических реакциях и обладать большим потенциалом в промышленном производстве.
Важно отметить, что не все оксиды являются амфотерными. Химическая структура и электрохимические свойства материала влияют на его амфотерность, и только некоторые соединения обладают этими особенностями.
Основное понятие о амфотерных оксидах

Амфотерные оксиды – это оксиды, которые могут проявлять свойства как кислот, так и оснований в зависимости от условий. Термин "амфотерный" происходит от греческого "амфотероς", что можно перевести как "оба" или "обоюдный". Это свойство амфотерных оксидов позволяет им образовывать соли как с кислотами, так и с основаниями.
Наиболее известным примером амфотерного оксида является оксид алюминия (Al2O3). При реакции с кислотами, оксид алюминия действует как основание и образует соли. Например, соляная кислота (HCl) и оксид алюминия дают алюминиевую соль и воду:
| Реагенты | Продукты |
|---|---|
| Al2O3 + 6 HCl | 2 AlCl3 + 3 H2O |
Однако, при реакции с основаниями, оксид алюминия действует как кислота, образуя соли. Например, оксид алюминия и гидроксид натрия дают соль алюминия и воду:
| Реагенты | Продукты |
|---|---|
| Al2O3 + 2 NaOH + 3 H2O | 2 Na[Al(OH)4] |
Таким образом, амфотерные оксиды являются важными соединениями и обладают уникальными свойствами, что делает их полезными в различных химических реакциях и процессах.
Свойства амфотерных оксидов и их реакции
Амфотерные оксиды, также известные как амфотерные соединения, обладают способностью проявлять свойства и сродство как к кислороду, так и к основанию. Это означает, что они могут вступать как в кислотные, так и в щелочные реакции.
Свойства амфотерных оксидов напрямую зависят от их химической структуры и связей между элементами. Оксиды металлов у мест, расположенных ниже в ряду активности металлов, обычно проявляют свойства амфотерности. Примерами амфотерных оксидов являются оксиды алюминия (Al2O3), свинца (PbO), цинка (ZnO) и другие.
Амфотерные оксиды могут взаимодействовать как с кислотами, так и с основаниями. В реакции с кислотами они проявляют основные свойства, принимая от кислоты протон. С другой стороны, взаимодействуя с основаниями, они проявляют кислотные свойства, отдавая протон основанию.
Реакция амфотерных оксидов с кислотами приводит к образованию солей и воды. Например, реакция оксида алюминия с серной кислотой приводит к образованию сульфата алюминия:
Al2O3 + H2SO4 → Al2(SO4)3 + H2O
При взаимодействии амфотерных оксидов с основаниями образуются соли и вода. Например, реакция оксида свинца с гидроксидом натрия дает ацетат свинца и воду:
PbO + 2NaOH → Pb(CH3COO)2 + H2O
Следует также отметить, что амфотерные оксиды могут реагировать с водой при образовании гидроксидов. Например, реакция оксида цинка с водой дает гидроксид цинка:
ZnO + H2O → Zn(OH)2
Свойства амфотерных оксидов и их реакции определяют их широкое использование в различных областях, таких как химическая промышленность, фармацевтика, производство электродов и других. Кроме того, амфотерные оксиды играют важную роль в регулировании рН водных растворов и поддержании химического равновесия в различных системах.
Реакции кислотных оксидов

Вода является одним из наиболее распространенных веществ, с которым кислотные оксиды реагируют. В результате такой реакции образуется кислота. Например, оксид серы СО2 при взаимодействии с водой образует серную кислоту H2SO3:
CO2 + H2O → H2CO3
Также кислотные оксиды могут реагировать с щелочными оксидами, приводя к образованию солей. Например, при реакции оксида калия K2O и диоксида серы SO2 образуется калиевая соль сернистой кислоты:
K2O + SO2 → K2SO3
Кроме того, кислотные оксиды могут реагировать с основаниями, образуя соли. Например, оксид серы СО2 при реакции с гидроксидом натрия NaOH образует натриевую соль угольной кислоты:
CO2 + 2NaOH → Na2CO3 + H2O
Таким образом, реакции кислотных оксидов могут приводить к образованию кислот, солей или других соединений в зависимости от вещества, с которым они взаимодействуют.
Активность и реакционная способность кислотных оксидов
Активность кислотных оксидов зависит от их структуры и электроотрицательности неметалла. Чем больше электроотрицательность неметалла, тем более активным будет его оксид.
Кислотные оксиды могут взаимодействовать с водой, образуя кислоты. Это реакция гидратации, в результате которой образуется кислота и высвобождается большое количество тепла. Некоторые оксиды, такие как оксид серы, оксид азота и оксид углерода, также обладают реакционной способностью с другими веществами.
Реакция кислотных оксидов с основаниями приводит к образованию соответствующих солей и воды. Например, оксид серы может реагировать с гидроксидом натрия, образуя сернокислый натрий и воду:
- S02 + 2NaOH → Na2SO3 + H2O
Реакция кислотных оксидов с металлами приводит к образованию солей в виде соответствующих оксидов металлов. Например, оксид алюминия может реагировать с магнием, образуя алюминат магния:
- 2Al2O3 + 3Mg → 3MgO • Al2O3
Кислотные оксиды также обладают реакционной способностью с противоположными оксидами, амфотерными оксидами. Это способность активных кислотных оксидов взаимодействовать как с основаниями, так и с кислотами. Например, оксид алюминия может реагировать как с щелочью (натрием гидроксидом), так и с кислотой (кислотой соляной), образуя соответствующие соли и воду:
- Al2O3 + 6NaOH → 2Na3AlO3 + 3H2O
- 2Al2O3 + 6HCl → 2AlCl3 + 3H2O
Активность и реакционная способность кислотных оксидов играют важную роль во многих химических процессах и реакциях. Изучение их свойств помогает понять и объяснить многие химические явления и взаимодействия в природе и промышленности.



