Химическое равновесие - это состояние, при котором скорости протекания прямой и обратной реакций становятся равными. Важным фактором в процессе достижения равновесия является наличие катализаторов. Катализаторы - это вещества, которые могут ускорять реакцию без своего участия в ней.
С помощью катализатора возможно сместить химическое равновесие в сторону образования продуктов реакции. Катализатор повышает скорость экзотермической реакции, обеспечивая более быстрое образование конечной продукции.
Процесс смещения равновесия с помощью катализатора возможен благодаря тому, что катализатор снижает энергию активации реакции. Это означает, что для прохождения реакции достаточно меньшего количества энергии, что ускоряет протекание реакции.
Важно отметить, что катализаторы не изменяют энергию активации обратной реакции, поэтому направление равновесия не меняется. Однако, благодаря более быстрой реакции в сторону образования продуктов, катализатор может эффективно сместить равновесие в сторону большего образования продуктов.
Катализаторы: сдвиг равновесия в химических реакциях

Во многих химических реакциях равновесие достигается только под определенными условиями, например, определенной температурой и давлением. Однако, катализаторы могут сдвинуть равновесие в пользу одной из реакций, ускоряя или замедляя скорость протекания реакции.
Катализаторы - это вещества, которые участвуют в реакции, но остаются непотребленными по ее завершении. Они увеличивают скорость реакции, снижая энергию активации, необходимую для протекания реакции. Катализаторы действуют путем предоставления альтернативного пути реакции с меньшей энергией активации, что позволяет большему числу молекул превратиться в продукты.
Изменение скорости реакции за счет катализатора может привести к смещению равновесия в химической системе. Например, если применить катализатор к реакции, идущей в прямом направлении, то скорость этой реакции возрастет. В результате этого увеличится и концентрация продуктов реакции, что сдвинет равновесие в сторону образования продуктов.
Однако, катализаторы также могут сдвигать равновесие в обратную сторону. Например, если катализатор применяется к реакции, идущей в обратном направлении, то скорость обратной реакции может увеличиться. Это приведет к снижению концентрации продуктов и сдвигу равновесия в сторону реагентов.
Таким образом, катализаторы могут играть важную роль в изменении равновесия химических реакций. Они могут ускорять или замедлять скорость реакций и сдвигать равновесие в пользу одного из направлений. Использование катализаторов позволяет увеличить выход продуктов и повысить эффективность химических процессов.
Катализаторы и их роль в химических процессах
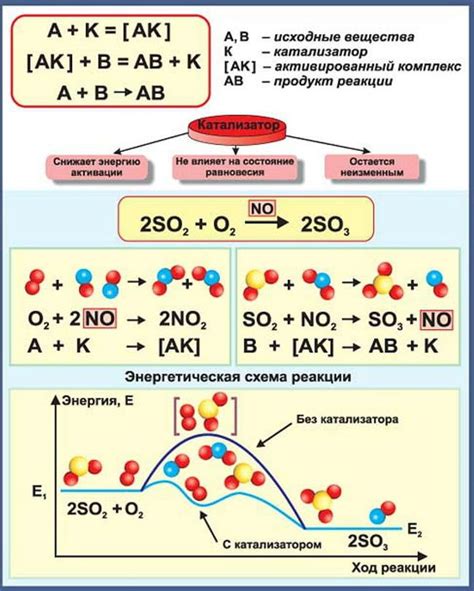
Роль катализаторов заключается в снижении активационной энергии реакции, что позволяет химической системе достичь равновесия быстрее и эффективнее. Они работают путем предоставления поверхности, на которую могут собираться реагенты и взаимодействовать между собой. Благодаря этому, реакции проходят быстрее и без значительного расхода энергии.
Катализаторы могут быть гетерогенными и гомогенными. Гетерогенные катализаторы находятся в различных фазах с реагентами и продуктами реакции, а гомогенные катализаторы – в одной фазе. Оба вида катализаторов обладают своими преимуществами и недостатками и могут быть использованы в различных химических процессах.
Катализаторы также играют важную роль в смещении химического равновесия. Они могут направлять реакцию в нужном направлении, предотвращая обратное превращение продуктов обратно в реагенты. Это достигается благодаря взаимодействию катализатора с определенными компонентами реакционной системы и созданию новых путей реакции.
Химическое равновесие и его определение

Химическое равновесие характеризуется равенством значений равновесной постоянной (константы равновесия), и оно зависит от температуры, давления и концентраций веществ в системе. При изменении одного из этих параметров равновесие может быть смещено в сторону образования большего количества продуктов или реагентов.
Использование катализатора позволяет ускорить химическую реакцию, не влияя на конечное положение равновесия. Катализаторы обычно увеличивают скорость обратной реакции и прямой реакции, поэтому они не способны сместить равновесие в определенную сторону. Однако, за счет повышенной скорости реакции, катализаторы могут помочь достичь равновесного состояния быстрее.
Влияние катализаторов на сдвиг равновесия
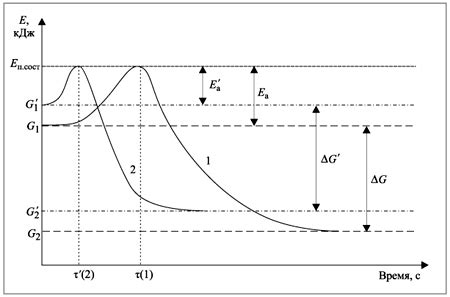
Равновесие химической реакции определяется соотношением концентраций и скоростей прямой и обратной реакций. При этом, состояние равновесия может быть изменено с помощью добавления катализаторов. Катализаторы могут ускорять химические реакции, что влияет на распределение веществ между продуктами и реагентами.
Основная роль катализаторов заключается в изменении энергетических барьеров реакций. Катализаторы снижают энергию активации, необходимую для протекания реакции, благодаря чему ускоряют химическую реакцию. При этом, катализаторы не влияют на химическое равновесие в общем смысле.
Однако, на микроуровне катализаторы все же влияют на равновесие. Катализаторы, ускоряя обратную реакцию, помогают поддерживать равновесие за счет выделения дополнительного количества продукта. В итоге, концентрация продукта увеличивается, что приводит к смещению равновесия в сторону продуктов.
Также, добавление катализаторов может приводить к изменению равновесной позиции. Например, в реакциях, где выделение газа является одним из продуктов, катализаторы могут ускорить этот процесс, что сместит равновесие в сторону образования большего количества газа.
Влияние катализаторов на равновесие химических реакций может быть использовано для управления направлением реакции и повышения выхода желаемого продукта. Однако, стоит учитывать, что катализаторы не могут создать новое равновесие, а только сместить уже существующее.
Примеры реакций с смещением равновесия под действием катализаторов

Катализаторы могут играть важную роль в смещении равновесия химических реакций. Они могут ускорять обратимые реакции и повышать выход желаемых продуктов. Ниже представлены некоторые примеры таких реакций:
- Водородация (реакция насыщения) – это процесс, в котором двойная связь в органических молекулах превращается в одиночные связи. Катализаторы, такие как платина, палладий или никель, могут активировать водород и способствовать его реакции с двойными связями. Это позволяет сместить равновесие в сторону образования насыщенных соединений.
- Реакция обратимого обезвоживания – в этой реакции гидрат образует газ и вода. Катализаторы, такие как черная железная окись, могут ускорять образование газа и смещение равновесия в сторону его выделения.
- Процесс аминоциклизации – это реакция, в результате которой образуется циклическое амидное соединение. Катализаторы, такие как палладий на угле, могут помочь активировать амид и способствовать его реакции с другими соединениями, чтобы образовать цикл.
- Метатезис диенов – это реакция, при которой два диена образуют новые диены путем перемещения двойных связей. Катализаторы, такие как рутений карбенового типа, могут помочь активировать диены и ускорить их реакцию между собой.
- Эстерификация – это реакция, в результате которой образуется эфирный или кетонный соединение из кислоты и спирта. Катализаторы, такие как кислотные сильные сульфаты, могут ускорить реакцию и сместить равновесие в сторону образования эфира или кетона.
Это только несколько примеров реакций, в которых катализаторы могут сместить равновесие в желаемом направлении. Катализаторы играют важную роль в химии, позволяя улучшить скорость реакций и повысить выход желаемых продуктов.
Факторы, влияющие на эффективность катализаторов в переводе равновесия

Катализаторы играют важную роль в химических реакциях, позволяя смещать равновесие в желаемом направлении. Однако эффективность катализаторов может варьироваться в зависимости от нескольких факторов:
1. Активность катализатора: Активность катализатора определяет его способность стимулировать химическую реакцию. Чем выше активность катализатора, тем быстрее происходит реакция и тем эффективнее катализатор в переводе равновесия.
2. Селективность катализатора: Селективность катализатора определяет его способность выбирать определенные продукты реакции. Хороший катализатор должен обладать высокой селективностью, чтобы обеспечить образование желаемых продуктов и снизить образование побочных продуктов.
3. Температура реакции: Температура является важным фактором, влияющим на эффективность катализатора. В некоторых случаях повышение температуры может увеличить скорость реакции, однако слишком высокая температура может стать причиной деградации катализатора.
4. Концентрация реагентов: Концентрация реагентов также может влиять на эффективность катализатора. Высокая концентрация реагентов может способствовать более интенсивной взаимодействию с катализатором и повышению скорости реакции.
5. Вид катализатора: Вид катализатора может существенно влиять на его эффективность в переводе равновесия. Различные виды катализаторов имеют различную способность стимулировать реакции и смещать равновесие в определенном направлении.
6. Размер и форма катализатора: Размер и форма катализатора могут также оказывать влияние на его эффективность. Большая поверхность катализатора может обеспечить большую площадь контакта с реагентами и увеличить вероятность их взаимодействия с катализатором, что повысит скорость реакции.
Все эти факторы взаимосвязаны и в совокупности определяют эффективность катализатора в переводе химического равновесия.



