Катализаторы - это вещества, которые ускоряют химическую реакцию, не участвуя в ней без оставления каких-либо следов. Они играют важную роль в промышленных процессах и в ежедневной жизни, ускоряя процессы, которые обычно протекают медленно. Благодаря катализаторам мы можем получать продукты быстрее, экономя при этом время и ресурсы.
Скорость реакции - это замеряемый параметр, который показывает, как быстро происходит превращение исходных веществ в конечные продукты. Использование катализатора существенно изменяет этот процесс, ускоряя его. Катализаторы действуют, понижая энергию активации реакции - минимальную энергию, которую необходимо иметь у частиц для преодоления барьера реакции и приведения к образованию продуктов.
Катализаторы могут быть разных типов. Некоторые из них называются гомогенными, когда катализатор находится в одной фазе с реакционными веществами, и другие называются гетерогенными, когда катализатор находится в разной фазы с реакционными веществами.
Влияние катализатора на скорость реакции зависит от его специфичности к реакции и концентрации веществ. Катализаторы могут быть избирательными, ускоряя только определенные химические реакции, или неизбирательными, воздействуя на широкий спектр реакций. Правильный выбор катализатора может существенно повлиять на скорость реакции и увеличить ее эффективность.
Роль катализаторов в химических реакциях

Катализаторы играют ключевую роль в химических реакциях, ускоряя их протекание и позволяя достигать требуемой скорости реакции при более низкой температуре и с меньшими энергетическими затратами.
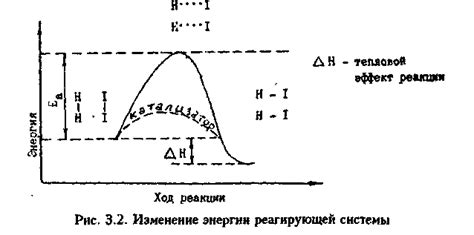
Одной из основных функций катализаторов является снижение активационной энергии реакции. Катализаторы ускоряют реакцию, предоставляя альтернативный путь с меньшей энергией активации. Это достигается за счёт образования промежуточных активированных комплексов с участниками реакции и уменьшением их энергетического порога. Таким образом, благодаря катализаторам, реакция происходит быстрее.
Катализаторы могут быть разделены на две основные группы: гомогенные и гетерогенные. Гомогенные катализаторы растворены в реакционной среде, в то время, как гетерогенные катализаторы находятся в фазе, отличной от фазы реакционной смеси. Гомогенные катализаторы обычно имеют молекулярную структуру и взаимодействуют с реагентами на молекулярном уровне. Гетерогенные катализаторы, напротив, представляют собой поверхности, на которых реакционные частицы адсорбируются и взаимодействуют друг с другом.
Катализаторы могут быть использованы для ускорения различных типов реакций, включая окислительно-восстановительные реакции, гидрирование, декарбоксилирование и другие. Они являются несамостоятельными участниками реакций, поскольку не расходуются в процессе и могут быть восстановлены для последующего использования.
В конечном счете, катализаторы способствуют повышению эффективности химических процессов, снижают энергозатраты и позволяют производить важные продукты на промышленном уровне.
Механизмы увеличения скорости реакции при применении катализаторов
1. Повышение концентрации реагентов: Катализаторы способны повышать концентрацию реагентов в активных центрах катализатора, что увеличивает вероятность их взаимодействия и ускоряет химическую реакцию.
2. Снижение активации реакции: Катализаторы могут снижать энергию активации химической реакции, необходимую для начала реакции. Это делает реакцию более доступной и увеличивает скорость прохождения реакции.
3. Изменение механизма реакции: Катализаторы могут изменять механизм реакции, ускоряя определенные этапы реакции и повышая производительность. Они могут образовывать промежуточные соединения с реагентами или стабилизировать переходные состояния, что ускоряет реакцию.
4. Обеспечение нового пути реакции: Катализаторы могут обеспечивать новый путь для реакции, который иначе был бы недоступен без катализатора. Это позволяет провести реакцию более эффективно и с большей скоростью.
5. Увеличение поверхности реагентов: Катализаторы могут изменять структуру поверхности реагентов, что увеличивает их площадь контакта друг с другом. Это способствует более интенсивному взаимодействию реагентов и повышает скорость реакции.