Все элементы химической таблицы Менделеева можно разделить на две большие группы: металлы и неметаллы. В отличие от металлов, неметаллы обладают специфическими свойствами, которые определяют их химическую активность и использование в различных областях науки и техники. Однако, не все неметаллы обладают одинаковыми химическими свойствами. Некоторые неметаллы могут обладать более выраженными неметаллическими свойствами, чем другие. В данной статье рассмотрим факторы и закономерности, которые определяют увеличение неметаллических свойств по таблице Менделеева.
Одним из факторов, влияющих на увеличение неметаллических свойств, является электроотрицательность элемента. Чем выше электроотрицательность элемента, тем больше его способность привлекать электроны к себе. Неметаллы с высокой электроотрицательностью обычно обладают такими свойствами, как высокая электропроводность, низкая теплопроводность, хрупкость и низкая плотность.
Другим важным фактором, влияющим на увеличение неметаллических свойств, является размер атома. Чем меньше атом, тем выше его электронная плотность. Неметаллы с маленькими атомами обычно обладают высокой электронной плотностью и, следовательно, более выраженными неметаллическими свойствами, такими как высокая активность в химических реакциях или высокая температура кипения и плавления.
Неметаллы в таблице Менделеева: общая информация
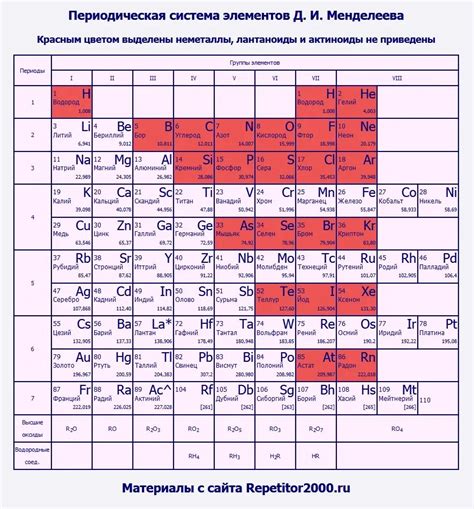
Неметаллами в химические элементы называют такие вещества, которые обладают низкой теплопроводностью и электропроводностью. Они также обладают низкой плотностью и обычно не имеют гладкой металлической поверхности. В таблице Менделеева неметаллы расположены в правой верхней части, а также в группах 14-16.
Неметаллы обладают разнообразными химическими, физическими и электронными свойствами. Они образуют соединения с другими элементами, такие как оксиды, сульфиды, хлориды и др., которые могут иметь различные свойства и применения. Некоторые неметаллы, такие как кислород и азот, являются основными составными элементами атмосферы Земли.
Кроме того, неметаллы играют важную роль в биологических системах и веществах, таких как ДНК, белки и углеводы. Они также широко используются в различных отраслях промышленности, включая электронику, пластиковую и резиновую промышленность, а также в производстве керамики, стекла и многих других материалов.
Некоторые из наиболее известных неметаллов в таблице Менделеева включают водород, кислород, азот, фосфор, серу, хлор, бром и йод. Каждый из этих элементов имеет свои уникальные свойства и применения, которые делают их важным для нашей повседневной жизни и научных исследований.
Химические элементы без металлических свойств
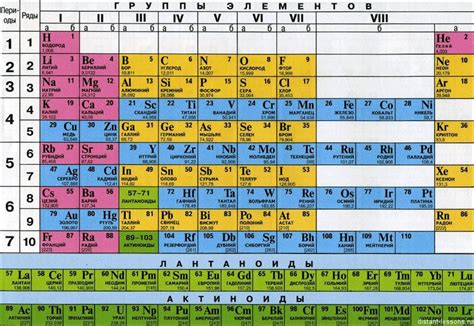
В таблице Менделеева существует некоторое количество химических элементов, которые не обладают металлическими свойствами. Они имеют свои уникальные характеристики и часто отличаются от большинства других элементов.
Эти неметаллы часто представляют собой непрозрачные вещества с прекрасными аллотропами, высокой электроотрицательностью и низкими температурами плавления и кипения. Они обладают хорошей электроизоляцией и негативным температурным коэффициентом сопротивления.
Одним из примеров таких элементов является кислород (O). Он обладает ярко-синим газообразным аллотропом, который играет невероятно важную роль в многих биохимических процессах. Его свойства оказывают влияние на окислительные-восстановительные реакции, а также могут быть использованы в качестве окислителя в различных химических реакциях.
Другим примером является флуор (F). Он обладает достаточно высокой электроотрицательностью и является самым реактивным химическим элементом в таблице Менделеева. Флуор и его соединения широко используются в различных отраслях науки и промышленности, в том числе для получения специальных стекол и полимеров.
Еще одним примером является азот (N). Он образует прекрасный двуокись азота, который является желтым кристаллом с грибовидной структурой. Азот играет важную роль в природе, например, в атмосфере Земли. Он вносит существенный вклад в образование нитратов и аммониевых соединений, которые являются неотъемлемой частью питательных сред и удобрений.
- Кислород (O)
- Флуор (F)
- Азот (N)
Это лишь некоторые примеры неметаллических элементов, их много больше в таблице Менделеева. Каждый из них имеет свои уникальные свойства и находит применение во многих научных и промышленных областях. Изучение этих элементов помогает расширить наши знания о химических процессах и создать новые материалы и соединения.
Факторы, влияющие на неметаллические свойства

Один из основных факторов, влияющих на неметаллические свойства, - это строение атомов неметаллов. Атомы неметаллов обычно образуют ковалентные связи, в которых они делят электроны соседних атомов. Это приводит к образованию многочисленных маленьких групп атомов, которые образуют макромолекулы или кристаллическую структуру. Такое строение делает неметаллы хрупкими и менее податливыми к деформации, по сравнению с металлами.
Еще одним фактором, влияющим на неметаллические свойства, является электронная структура атомов неметаллов. У неметаллов внешний энергетический уровень обычно содержит непарные электроны, что делает их хорошими загадочными активными веществами и прекрасными окислителями. Также неметаллы имеют высокое электроотрицательность, что делает их хорошими неэлектролитами и плохими электропроводниками.
Кроме того, факторами, влияющими на неметаллические свойства, являются кристаллическая структура и структурные особенности. Такие факторы, как размеры и форма элементарных ячеек, воздействуют на множество физических и химических свойств неметаллов, включая плотность, температуру плавления и испарения, а также вязкость и твердость.
В целом, неметаллические свойства неметаллов являются результатом многих факторов, включая их строение атомов, электронную структуру, кристаллическую структуру и структурные особенности. Понимание этих факторов помогает нам лучше понять и объяснить различные неметаллические свойства элементов и их положение в таблице Менделеева.
Число электронов во внешней оболочке

В таблице Менделеева периодический закон прослеживается с увеличением номера элемента. По мере движения слева направо, число электронов во внешней оболочке увеличивается на единицу. В результате, электростатическое притяжение ядра к электронам уменьшается, что способствует увеличению радиуса атома и слабым связям между атомами. Это объясняет, почему элементы возрастают по неметаллическим свойствам по периоду слева направо.
Однако, есть исключения из этой закономерности. Например, галогены (группа 17) не обладают свойствами металлов, несмотря на то, что они находятся справа в таблице Менделеева. Это связано со специфическими свойствами электронной оболочки и высокой электроотрицательностью этих элементов, что делает их сильными окислителями и хорошими элементами для образования ионов.
Таким образом, число электронов во внешней оболочке элемента играет важную роль в определении его химических свойств, а таблица Менделеева помогает установить закономерности в изменении этих свойств по периоду и группам.
Электроотрицательность элемента
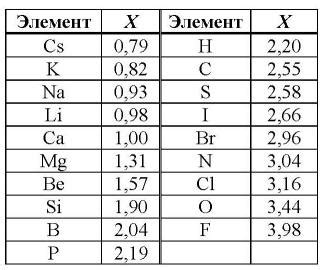
Электроотрицательность элемента определяется по шкале Полинга, в которой самый электроотрицательный элемент - флуор (F) со значением электроотрицательности 4.0. Чем выше значение электроотрицательности элемента, тем сильнее он притягивает электроны в химических связях.
Электроотрицательность элемента напрямую влияет на вид и тип химических связей, которые он образует. Если элемент имеет высокую электроотрицательность, то он образует ионные связи с элементами с низкой электроотрицательностью, передавая им свои электроны. Если элементы имеют примерно одинаковую электроотрицательность, то они могут образовывать ковалентные связи, в которых электроны распределяются равномерно между атомами.
На основе электроотрицательности элементов можно предсказать их химические свойства. Например, элементы с высокой электроотрицательностью обычно обладают высокой химической активностью и имеют склонность к образованию соединений с элементами с низкой электроотрицательностью.
Таблица Менделеева предоставляет информацию о электроотрицательности каждого элемента, что позволяет исследователям и химикам более точно понимать и предсказывать свойства веществ и реакций.
| Элемент | Символ | Электроотрицательность |
|---|---|---|
| Водород | H | 2.20 |
| Углерод | C | 2.55 |
| Кислород | O | 3.44 |
| Фтор | F | 3.98 |
В данной таблице приведены примеры электроотрицательности нескольких элементов. Расположение элементов в таблице Менделеева позволяет исследователям и химикам проводить анализ и предсказывать свойства элементов и их соединений на основе их электроотрицательности.
Закономерности в изменении неметаллических свойств
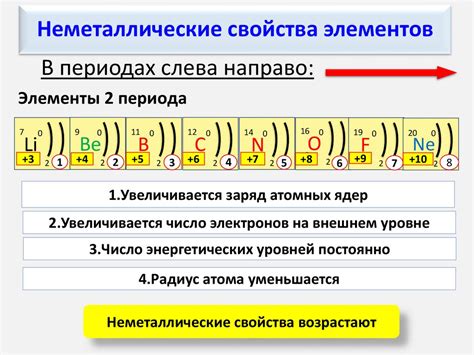
Таблица Менделеева, основанная на закономерностях в изменении химических свойств элементов, позволяет изучать и предсказывать свойства неметаллов.
Периодический закон утверждает, что неметаллические элементы находятся в верхнем правом углу таблицы Менделеева. Они расположены ближе к газообразному состоянию, так как их атомы имеют большое количество электронов во внешней оболочке и обладают высокой энергией и тенденцией к получению электронов. Благодаря этому, неметаллы обладают рядом характерных свойств.
Электроотрицательность: вещества, обладающие высокой электроотрицательностью, это неметаллы. Они стремятся привлечь к себе электроны и ионизировать другие вещества.
Электропроводность: неметаллы имеют малую электропроводность, так как их молекулы не образуют ионы, способные переносить электрический ток. За исключением, например, графита или графеновых структур.
Валентность: неметаллы имеют высокую валентность и характеризуются большим количеством связей, формируемых с электронафинными элементами. Они обладают способностью образовывать многие соединения с другими элементами.
Реакционная способность: неметаллы обладают большой реакционной способностью в химических реакциях. Они способны образовывать соединения с различными элементами и оформлять все основные типы химических связей.
Теплопроводность: неметаллы обладают низкой теплопроводностью. Их электроны слабо двигаются по решетке, что затрудняет передачу тепла.
Знание данных закономерностей в изменении неметаллических свойств позволяет более глубоко проникнуть в природу и химические реакции различных элементов, что находит применение в различных сферах научных исследований.



