Определение количества молекул является важным аспектом в физике и статистической механике. Молекулы - это мельчайшие частицы вещества, состоящие из атомов, и их количество может иметь значительное влияние на различные физические процессы.
Существует несколько методов, которые позволяют определить количество молекул в данной системе. Один из таких методов основан на использовании уравнения состояния идеального газа, которое описывает связь между давлением, объемом и температурой газа. Зная эти параметры, можно определить количество молекул в системе.
Другой метод основан на использовании формулы Авогадро, которая устанавливает соотношение между массой, количеством молекул и молярной массой вещества. С ее помощью можно определить количество молекул, зная массу и молярную массу.
Определение количества молекул играет важную роль в различных областях физики, включая химию, термодинамику и физическую химию. Это позволяет исследователям получить более точную информацию о свойствах вещества и предсказывать его поведение в различных условиях.
Молекулы в физике: общая информация
Молекулы существуют в огромном разнообразии форм и размеров. Они могут быть простыми, состоящими из двух атомов, или сложными, состоящими из сотен и тысяч атомов. Молекулы могут быть органическими, такими как углеводы, белки и липиды, или неорганическими, такими как вода, соль и кислород.
Основные характеристики молекул, которые интересуют физиков, включают их форму, размеры, массу, энергетическое состояние и взаимодействие с другими молекулами и частицами. Изучение этих характеристик позволяет понять поведение вещества в различных условиях, таких как высокие и низкие температуры, высокие давления и различные физические поля.
Определение количества молекул вещества имеет фундаментальное значение в физике. Для этого используется понятие молярной массы - массы одного моля вещества. Молярная масса определяется с помощью экспериментальных данных и приводится в граммах на моль. Зная молярную массу вещества и его массу, можно определить количество молекул вещества с помощью формулы:
Количество молекул = (масса вещества / молярная масса) * число Авогадро
где число Авогадро равно приблизительно 6,022 x 10^23 молекул на моль.
Изучение молекул в физике позволяет лучше понять мир вокруг нас и развивать новые технологии, такие как разработка новых материалов, лекарств и энергетических систем.
Молекулы: структура и свойства
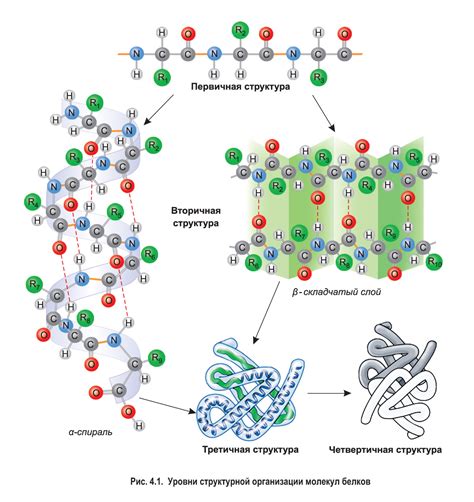
Молекулы представляют собой основные строительные единицы вещества. Они состоят из атомов, соединенных между собой химическими связями. Каждая молекула имеет свою уникальную структуру, которая определяет ее физические и химические свойства.
Структура молекулы включает в себя расположение атомов в пространстве и типы связей, которые их соединяют. Атомы в молекуле могут быть одного вида (например, молекула кислорода O2 состоит из двух атомов кислорода) или разных видов (например, молекула воды H2O состоит из двух атомов водорода и одного атома кислорода).
Физические свойства молекул связаны с их массой, формой и взаимодействием с другими молекулами. Например, молекулы с большой массой обычно имеют более высокую плотность и кипят при более высоких температурах. Форма молекулы может быть линейной, ациклической (нелинейной) или циклической, что влияет на ее свойства и поведение. Взаимодействие молекул определяет такие явления, как силы притяжения или отталкивания, что в свою очередь влияет на фазовые переходы и термодинамические свойства вещества.
Химические свойства молекул связаны с их способностью взаимодействовать и образовывать новые вещества. Это включает реакцию молекул с другими веществами, расщепление связей и образование новых связей. Химические свойства молекул определяют их роль в химических реакциях, процессах синтеза веществ и образования новых материалов.
Для изучения молекул и их свойств физики используют различные методы, такие как спектроскопия, рентгеноструктурный анализ, масс-спектрометрия и термодинамические методы. Эти методы позволяют определить структуру молекулы, массу и ее физические и химические свойства.
| Молекула | Формула | Физические свойства | Химические свойства |
|---|---|---|---|
| Вода | H2O | Жидкость при комнатной температуре, высокая теплопроводность | Участвует в химических реакциях гидролиза и образования кислот и оснований |
| Кислород | O2 | Газ при комнатной температуре, поддерживает горение и дыхание | Образует соединения с другими элементами и веществами |
| Метан | CH4 | Газ при комнатной температуре, горючий, безцветный и без запаха | Участвует в химических реакциях сжигания и образования других органических соединений |
Методы определения количества молекул

В физике существуют различные методы определения количества молекул в веществе. Они основаны на различных принципах и используют разные инструменты для получения точных результатов.
Один из методов - измерение массы вещества. Используя известные химические формулы и молярную массу вещества, можно определить количество молекул в нем. Для этого необходимо измерить массу отдельного вещества и сравнить ее с молярной массой. Этот метод широко используется в химических лабораториях для определения количества вещества.
Другой метод - газовые законы. Они позволяют определить количество молекул газа на основе его объема, давления и температуры. Например, закон Авогадро показывает, что один моль любого газа содержит одинаковое количество молекул, независимо от его состава. Поэтому, зная объем и другие параметры газа, можно определить количество молекул в нем.
Также существуют методы, основанные на использовании спектрального анализа. Каждая молекула имеет свой собственный спектральный отпечаток, который можно использовать для определения ее количества. Анализ спектров может производиться как с помощью оптических приборов, так и с использованием спектральных методов в ядерной магнитной резонансной томографии.
| Метод | Описание |
|---|---|
| Измерение массы | Использование химических формул и молярной массы вещества для определения количества молекул |
| Газовые законы | Использование объема, давления и температуры газа для определения количества молекул |
| Спектральный анализ | Использование спектральных отпечатков молекул для определения их количества |
Каждый из этих методов имеет свои преимущества и ограничения. Выбор метода зависит от конкретной задачи и доступных инструментов. Важно подходить к определению количества молекул вещества с учетом особенностей и исходных данных задачи.
Гидротермальный синтез

В гидротермальном синтезе используются специальные реакторы, которые создают необходимые условия для роста кристаллов. Основными параметрами, определяющими процесс, являются температура, давление и время реакции.
Важным аспектом гидротермального синтеза является выбор правильных реагентов и их соотношения, а также контроль параметров среды. Это позволяет получить нужные структуры и свойства материалов.
Гидротермальный синтез широко используется в различных областях науки и технологии. Например, он применяется в процессе создания новых материалов для электроники, катализаторов, фотокатализаторов и других функциональных материалов.
Преимущества гидротермального синтеза:
- Позволяет синтезировать материалы с высокой чистотой и определенными структурами;
- Управляемый процесс роста кристаллов;
- Позволяет получать наноматериалы с уникальными свойствами;
- Применимость к различным типам материалов и реакций.
Гидротермальный синтез представляет собой мощный инструмент для создания и изучения новых материалов с уникальными свойствами. Его применение в различных научных областях позволяет расширять границы возможностей исследователей и создавать инновационные материалы для различных применений.
Масс-спектрометрия

Принцип масс-спектрометрии заключается в следующем. Сначала образец анализируемого вещества превращается в ионизированное состояние, т.е. атомы или молекулы приобретают электрический заряд. Затем ионы разделяются по массе при помощи магнитного поля или электрического поля. Разделение происходит на основе отношения заряда к массе иона, известного как масс-зарядовое отношение.
Полученные разделенные ионы затем регистрируются детектором, их заряд определяется и записывается. В результате получается спектр, который представляет собой график интенсивности ионов относительно их массы. Изучение этого спектра позволяет идентифицировать состав вещества, определить молекулярную структуру и состояние элементов, а также оценить их концентрацию.
Масс-спектрометрия имеет множество применений в научных исследованиях и практических задачах. Например, она используется для исследования химического состава образцов, анализа биомолекул, определения радиоизотопного состава, контроля качества продуктов питания и лекарственных препаратов, а также в криминалистике и многих других областях.
Масс-спектрометрия является мощным инструментом для исследования молекулярных и атомных структур. Она позволяет проводить точный и чувствительный анализ проб, а также изучать различные физические, химические и биологические процессы на молекулярном уровне.
Применение методов для измерения количества молекул

В физике существует несколько методов, которые позволяют определить количество молекул в веществе.
- Метод Авогадро: основан на предположении, что один моль любого вещества содержит одинаковое количество молекул, равное числу Авогадро. Для определения количества молекул по этому методу используются данные об объеме газа, его давлении и температуре.
- Метод Брауна: основан на наблюдении движения мельчайших частиц в жидкостях или газах. Путем наблюдения и измерения их перемещения можно определить среднеквадратичное смещение частиц и вычислить количество молекул.
- Метод диффузии: основан на измерении скорости распространения вещества через газ или жидкость. Путем измерения времени, за которое вещество пройдет определенное расстояние, можно определить количество молекул.
- Метод рентгеноструктурного анализа: основан на использовании рентгеновского излучения для изучения структуры вещества на молекулярном уровне. Используя этот метод, можно получить информацию о расположении атомов и определить количество молекул.
Каждый из этих методов имеет свои особенности и применяется в разных ситуациях. Однако, благодаря ним, ученые могут определить количество молекул и изучать различные физические и химические явления на молекулярном уровне.
Молекулярная динамика
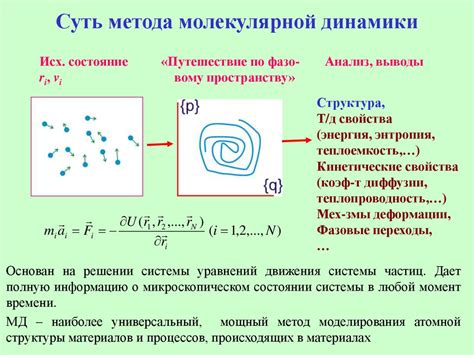
Метод молекулярной динамики позволяет исследовать свойства и поведение материалов на микроуровне, рассматривая их атомную и молекулярную структуру. Это важный инструмент в таких областях, как физика, химия, биология и материаловедение.
В молекулярной динамике каждая молекула моделируется как набор взаимодействующих частиц, таких как атомы. Для каждой частицы вычисляются силы взаимодействия с другими частицами, а затем рассчитываются их перемещения и скорости в течение определенного времени.
Молекулярная динамика позволяет исследовать различные физические и химические явления, такие как диффузия, конденсация, испарение, фазовые переходы и термодинамика. Он также позволяет изучать макроскопические свойства материалов, такие как вязкость, теплопроводность и прочность.
В результате молекулярной динамики можно получить детальную информацию о динамике и структуре системы. Это позволяет более глубоко понять различные физические процессы и использовать эту информацию для разработки новых материалов и технологий.
Химические реакции
Химические реакции могут протекать с образованием или поглощением энергии. Реакции, при которых происходит выделение энергии в виде тепла, называются экзотермическими реакциями. В таких реакциях свободная энергия исходных веществ выше, чем у конечных продуктов, и в результате освобождается тепло. Например, сгорание древесины или топлива – это экзотермические реакции.
Эндотермические реакции, наоборот, требуют поглощения энергии из внешней среды. В таких реакциях свободная энергия исходных веществ меньше, чем у конечных продуктов, и для протекания процесса необходимо подача энергии в виде тепла или других видов энергии. Например, распад азотной кислоты или фотосинтез – это эндотермические реакции.
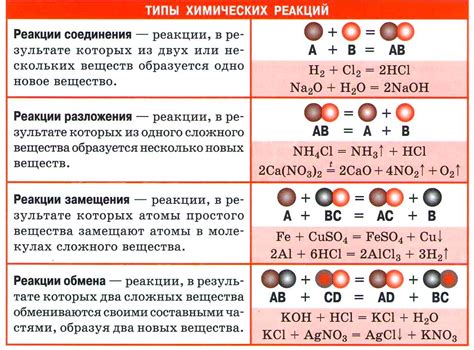
Химические реакции описываются химическими уравнениями, где вещества, участвующие в реакции, обозначаются химическими формулами. В уравнениях указываются коэффициенты, отражающие соотношение между количеством веществ, участвующих в реакции. Коэффициенты перед формулами веществ показывают, в каком соотношении они участвуют в реакции.
| Реакция | Уравнение |
|---|---|
| Горение метана | CH4 + 2O2 → CO2 + 2H2O |
| Распад воды | 2H2O → 2H2 + O2 |
| Взаимодействие кислорода и металла | 4Na + O2 → 2Na2O |
Важно отметить, что в химической реакции количество атомов каждого элемента должно быть одинаковым до и после реакции. Поэтому при составлении уравнений приводится коэффициенты, чтобы сбалансировать количество атомов на обеих сторонах реакции.



