Молекулы - это основные строительные блоки вещества. Они постоянно находятся в движении и обладают определенной скоростью. Интересно, что происходит с молекулами, когда среда, в которой они находятся, нагревается? Различается ли скорость движения молекул в горячей среде по сравнению с холодной?
Для ответа на эти вопросы необходимо понять, что такое температура и как она влияет на движение молекул. Температура - это мера средней кинетической энергии частиц вещества. Когда среда нагревается, частицы получают больше энергии и начинают двигаться быстрее. В результате, скорость движения молекул возрастает.
Однако, не все молекулы в равной степени ускоряются при нагревании среды. Некоторые молекулы могут оставаться относительно неподвижными, в то время как другие будут двигаться очень быстро. Это объясняется распределением скоростей молекул вещества. Распределение скоростей показывает, какая доля молекул движется с определенной скоростью. При нагревании среды, форма распределения скоростей может измениться, но некоторые молекулы всегда будут иметь очень низкую скорость, в то время как другие - очень высокую.
Горячая среда и скорость молекул

Горячая среда представляет собой состояние, при котором температура вещества выше обычной комнатной температуры. В горячей среде молекулы вещества обладают более высокой энергией и движутся с большей скоростью.
Скорость молекул в горячей среде определяется не только температурой, но и типом вещества и его физическими свойствами. В газообразных веществах молекулы движутся быстрее, чем в жидкостях или твердых веществах, так как молекулы в газе находятся на большем расстоянии друг от друга и испытывают меньшее влияние притяжения между ними.
Принцип равных скоростей молекул в горячей среде не всегда действует. Вещества с разными массами молекул могут иметь различные скорости при одинаковой температуре. Молекулы более легких веществ имеют обычно более высокую среднюю скорость, чем молекулы более тяжелых веществ при одинаковой энергии.
Изучение взаимодействия молекул в горячей среде помогает понять множество физических и химических процессов, таких как диффузия, испарение и реакции веществ. Знание о скорости движения молекул в горячей среде позволяет улучшить понимание флуктуаций, тепловых эффектов и прочих свойств вещества при повышенных температурах.
Скорость молекул и их энергия

Молекулы в горячей среде обладают большей кинетической энергией, которая определяется их скоростью. Кинетическая энергия молекулы зависит от массы и скорости движения. Чем больше масса молекулы и чем выше ее скорость, тем больше кинетическая энергия.
Скорость молекул может быть равномерной или неравномерной. Если среда содержит равномерное распределение энергии, то скорости молекул будут приблизительно одинаковыми. Однако в реальности неравномерное распределение энергии может приводить к разным скоростям молекул.
Энергия молекулы также может быть связана с ее внутренними степенями свободы, которые определяются ее внутренней структурой и химическими связями. Энергия молекулы может переходить из степеней свободы движения в поперечные колебания, вращательные движения и другие формы. В результате, молекулы обладают различными формами энергии, что влияет на их скорость и движение в горячей среде.
Равномерное распределение скоростей
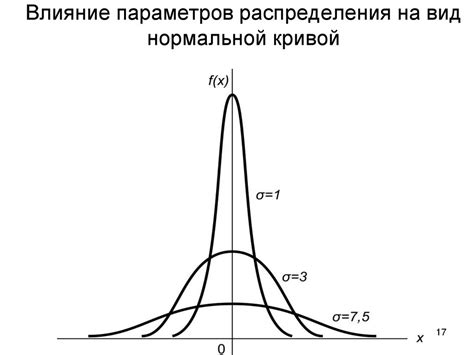
В горячей среде молекулы постоянно движутся, сталкиваются и обмениваются энергией. Вопрос о равенстве или неравенстве скоростей молекул часто интересует исследователей.
Согласно физическому закону, называемому распределением Максвелла-Больцмана, распределение скорости молекул в горячей среде является неравномерным. В соответствии с этим законом, некоторые молекулы обладают более высокой скоростью, тогда как другие движутся медленнее.
Однако существуют особые условия, при которых распределение скоростей может быть равномерным. Например, в идеальном газе при достижении термодинамического равновесия молекулы обладают равными скоростями. Это происходит из-за того, что молекулы идеального газа не взаимодействуют друг с другом и не обменивают энергию. Таким образом, в идеальном газе можно говорить о равномерном распределении скоростей молекул.
Тем не менее, в большинстве реальных систем равномерное распределение скоростей молекул в горячей среде невозможно из-за взаимодействия молекул друг с другом. Равенство скоростей молекул может быть достигнуто только на краткое мгновение в результате столкновений, однако на уровне атомной физики такие условия встречаются крайне редко.