Химическая связь - это силы, которые держат атомы в молекуле вместе. Определение вида связи в химии является важным шагом для понимания структуры и свойств вещества. Существуют различные виды химических связей, включая ионные, ковалентные и металлические связи. Определение вида связи может быть произведено путем анализа структуры молекулы и зарядов на атомах.
Ионные связи образуются путем переноса электронов от одного атома к другому, что приводит к образованию ионов с противоположными зарядами. Эти ионы притягиваются друг к другу электростатическими силами. Определить ионную связь можно, изучив заряды на атомах и виды ионов, образующихся в реакции.
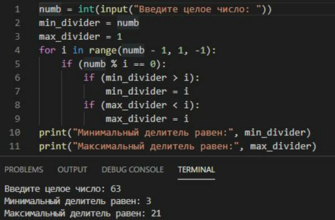
Ковалентные связи формируются, когда два атома делят пару электронов. Оба атома в этом случае вносят вклад в образование связи. Определить ковалентную связь можно путем анализа распределения электронной плотности, а также по длине и силе связи между атомами.
Металлические связи возникают между атомами металлов и характеризуются общим использованием свободных электронов, которые перемещаются между атомами. В металлических связях отсутствуют строго определенные положения атомов. Определить металлическую связь можно по физическим свойствам металлов и способности формирования плотных кристаллических решеток.
Определение химической связи

Существует несколько видов химической связи:
- Ионная связь – образуется в результате притяжения противоположно заряженных ионов;
- Ковалентная связь – образуется при обмене электронами между атомами;
- Металлическая связь – характерна для металлов, где свободные электроны образуют электронное облако, окружающее положительно заряженные ионы;
- Водородная связь – возникает между молекулярными двумя атомами с разными электроотрицательностями, один из которых обязательно является водородом;
- Вани-дер-Ваальсовы силы – слабые притяжения между неполярными молекулами, возникающие благодаря временному смещению электронной оболочки.
Определение вида химической связи вещества позволяет лучше понять его физические и химические свойства, а также прогнозировать реакционную способность и установить возможность его применения в различных областях науки и техники.
Ковалентная связь

Особенностью ковалентной связи является равноправность обоих атомов, которые делят находящиеся у них электроны. В то время как в ионной связи электроны полностью передаются от одного атома к другому, в ковалентной связи они образуют общую пару электронов, так называемый ковалентный электронный парами, или ковалентную пару. Образование ковалентной связи позволяет атомам достигнуть электронной конфигурации инертных газов, что делает систему более устойчивой.
Ковалентные связи могут быть одинарными, двойными или тройными. Одиночная ковалентная связь образуется, когда два атома делят между собой одну пару электронов. Двойная ковалентная связь образуется, когда атомы делят две пары электронов, а тройная ковалентная связь образуется при разделении трех пар электронов.
Ковалентные связи могут быть полярными или неполярными в зависимости от того, есть ли разница в электроотрицательности между атомами. Если разница в электроотрицательности невелика, связь считается неполярной. В случае большой разницы в электроотрицательности, связь считается полярной.
Ковалентные связи вещества могут быть представлены в виде структурных формул, где каждый атом представлен символом, а связи обозначаются линиями между атомами.
Механизм и признаки ковалентной связи
Прежде чем понять механизм ковалентной связи, необходимо знать, что внешняя оболочка атома состоит из электронных оболочек, каждая из которых имеет свой энергетический уровень. Обмен электронами происходит в том случае, если атомы имеют несбалансированные или неполные электронные оболочки. В результате этого обмена образуются связывающие пары электронов, которые держат атомы вместе и образуют ковалентную связь.
Ковалентная связь обладает определенными признаками, которые позволяют определить ее наличие:
- Общая возможность образования ковалентных связей - по правилу октета, атомы стремятся заполнить свою внешнюю электронную оболочку восемью электронами. Поэтому атомы могут образовывать ковалентные связи, чтобы достичь этой стабильной конфигурации.
- Способность к образованию ковалентной связи - ковалентная связь может образовываться между различными элементами, которые имеют различную электроотрицательность. Величина разности электроотрицательности определяет тип ковалентной связи (полярная или неполярная).
- Длина и энергия связи - межатомное расстояние между связанными атомами и энергия, необходимая для разрыва связи, зависят от атомных радиусов и степени наложения электронных облаков связанных атомов.
Механизм образования ковалентной связи зависит от электронной структуры связанных атомов. Если атомы имеют неполные электронные оболочки, они могут образовывать стандартные ковалентные связи, перенося друг другу электроны. Если один или оба атома имеют полностью заполненную электронную оболочку, они могут образовывать трехцентровые или четырехцентровые связи.
Таким образом, ковалентная связь обладает определенными признаками и механизмом образования, которые позволяют ее идентифицировать и расшифровывать.
Ионная связь

Ионная связь образуется, когда один атом отдает электрон(ы) другому атому, образуя положительный и отрицательный ионы соответственно. В результате образуются кристаллические структуры, такие как соль, где положительные ионы (катионы) и отрицательные ионы (анионы) притягиваются друг к другу.
Ионная связь обладает такими характеристиками:
| Характеристики | Описание |
|---|---|
| Силы взаимодействия | Очень сильные |
| Точка плавления и кипения | Высокая |
| Проводимость | Плохая в твердом состоянии, хорошая в расплавленном или растворенном состоянии |
| Растворимость | Высокая в воде и других полярных растворителях |
| Типичные примеры | Соли, такие как NaCl (хлорид натрия) |
Ионная связь играет важную роль во многих аспектах химии, таких как образование кристаллических структур, проводимость электричества в растворах, а также в составлении химических уравнений и прогнозировании реакций.
Как узнать, что речь идет об ионной связи?

Существует несколько признаков, по которым можно определить, что речь идет об ионной связи:
- Атомы соединенных веществ имеют значительное различие в электроотрицательности. Наличие атомов с большой и малой электроотрицательностью указывает на возможность образования ионной связи.
- Образование ионных связей характерно для металлов и неметаллов, которые находятся на противоположных концах периодической таблицы.
- Ионные соединения обычно обладают высокой температурой плавления и кипения, так как для их разрушения необходимо преодолеть силы электростатического взаимодействия ионов.
- В реакциях ионных соединений обычно происходит обмен ионами.
Если все эти признаки наблюдаются, то можно сказать, что речь идет об ионной связи.
Металлическая связь

Металлическая связь является достаточно слабой, что позволяет металлам быть гибкими и проводящими тепло и электричество. Все это объясняется специфическим строением кристаллической решетки металла, где положительно заряженные ионы металла вступают в связи с электронами, образуя общие свободные электронные облака.
Межатомное расстояние в металлической связи больше, чем в ионных и ковалентных связях, из-за наличия электронных облаков между металлическими ионами. Таким образом, металлы могут образовывать различные структуры, такие как металлические сплавы и жидкости.
Металлическая связь играет важную роль во многих сферах науки и техники. Она отвечает за механические и электрические свойства металлов, их способность проводить ток, тепло и показывает стабильность металлических соединений.