Оксиды - это химические соединения, состоящие из кислорода и других элементов. Важным свойством оксидов является их степень окисления, которая указывает на количество электронов, переданных оксиду при формировании соединения. В данной статье мы рассмотрим, как можно определить вид оксида по его степени окисления.
Определение степени окисления оксида позволяет определить его химическую активность, потенциал окислительно-восстановительных реакций, а также его возможные свойства и применение в различных сферах науки и промышленности. Для определения степени окисления оксида следует воспользоваться таблицей степеней окисления элементов и правилами определения окислителя и восстановителя в химической реакции.
При определении степени окисления оксида необходимо выяснить степень окисления кислорода в соединении, поскольку он всегда имеет степень окисления -2. Зная степень окисления кислорода и общую зарядность соединения, можно вычислить степень окисления других элементов в оксиде.
Таким образом, определение вид оксида по степени окисления является важным шагом в изучении химических соединений и позволяет получить информацию о свойствах и реакционной активности вещества. В дальнейшем эта информация может быть использована при разработке новых материалов и применении их в различных областях науки и техники.
Что такое оксид
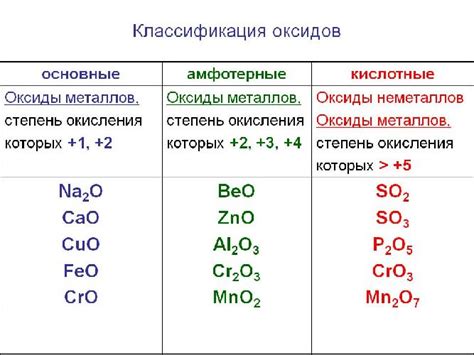
Оксиды обладают важными свойствами, которые определяют их специфические химические и физические свойства. Кислород, входящий в оксиды, может иметь разные степени окисления, что приводит к разным видам оксидов. Некоторые оксиды являются кислотно-основными оксидами, что означает, что они могут взаимодействовать с водой и образовывать кислоты или основания.
Оксиды широко используются в промышленности, медицине, сельском хозяйстве и других областях. Они играют важную роль в процессах окисления и восстановления, участвуют в реакциях с другими химическими соединениями и обладают различными физическими свойствами, такими как цвет, температурная стабильность и проводимость электричества.
Определение и основные свойства

| Вид оксида | Степень окисления |
|---|---|
| Пероксиды | -1 |
| Супероксиды | -1/2 |
| Оксиды | -2 |
| Оксиды полуэлементов | от -2 до +7 |
| Кислородные кислоты | 3 и выше |
Оксиды являются довольно универсальными веществами и обладают рядом основных свойств:
- Металлический характер - большинство оксидов являются соединениями металлов и обладает свойствами металлов
- Электроотрицательность - оксиды являются электроотрицательными соединениями и обычно проявляют кислотные свойства
- Фотохимическая активность - многие оксиды обладают способностью взаимодействовать с энергией света, что часто выражается в их окислительных свойствах
- Образование кислот - множество оксидов может реагировать с водой и образовывать кислоты
Определение вида оксида по его степени окисления позволяет понять его химические свойства и реакционные возможности.
Степень окисления оксида
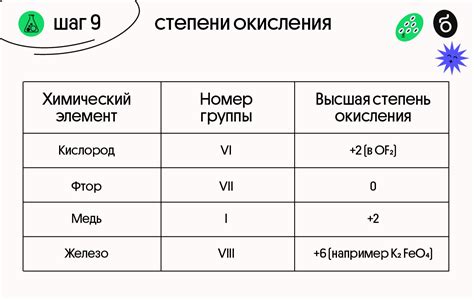
Определить степень окисления оксида можно по таблице степеней окисления, которая связывает элемент с его окислительным состоянием. Например, в оксиде меди (CuO) медь имеет степень окисления +2, а в оксиде серы (SO2) сера имеет степень окисления +4.
Также можно определить степень окисления кислорода в оксиде по степеням окисления других элементов в соединении. Например, в оксиде алюминия (Al2O3) степень окисления алюминия равна +3, а значит степень окисления кислорода равна -2.
Степень окисления оксида важно знать, так как она позволяет определить его свойства и возможные реакции с другими веществами. Кроме того, степень окисления оксида оказывает влияние на его название – оксиды с различными степенями окисления имеют разные названия.
| Элемент | Степень окисления в оксидах |
|---|---|
| Водород | +1 |
| Литий, натрий, калий, рубидий, цезий | +1 |
| Магний, кальций, стронций, барий, радий | +2 |
| Бериллий | +2 |
| Бор | +3 или +1 |
| Углерод | +4 или -4 |
| Азот | +5 или -3 |
| Фосфор | +5 или +3 |
| Кислород | -2 |
| Гелий, неон, аргон, криптон, ксенон, радон | 0 |
Как определить и выразить численно

Чтобы определить степень окисления вещества, необходимо учитывать правила, которые позволяют нам выразить ее численно.
- Определите сам элемент вещества и его окислительное число.
- Установите коэффициенты перед элементами, так чтобы сумма окислительных и восстановительных чисел была равна нулю.
- Если вещество является ионом, необходимо учитывать его заряд.
- В случае, если вещество является неионной, определите его окислительное число как число вещества.
- Если вещество входит в состав кислородсодержащей группы, окислительное число кислорода равно -2.
- Вещество, являющееся окислителем, записывается в скобках с указанием его окислительного числа со знаком "+".
- Вещество, являющееся восстановителем, записывается без скобок и с указанием его окислительного числа со знаком "-".
- Если окислительное число элемента является долевым, необходимо умножить все коэффициенты на наименьшее число, чтобы получить целые числа.
Таким образом, следуя указанным правилам, можно точно определить и выразить численно степень окисления вещества.
Система номенклатуры оксидов

Оксиды представляют собой химические соединения, состоящие из кислорода и другого элемента. Они обычно образуются при окислительных реакциях, в которых кислород передается от одного элемента к другому.
Система номенклатуры оксидов является частью общей системы номенклатуры химических соединений. В ней оксиды называются в соответствии с их степенью окисления. Степень окисления - это число, которое отражает сколько электронов было потеряно или получено элементом при образовании оксида.
| Степень окисления | Название оксида |
|---|---|
| +1 | Пероксид |
| -1 | Супероксид |
| +2 | Оксид |
| +3 | Триоксид |
| -2 | Диоксид |
| +4 | Тетраоксид |
Это основные названия оксидов в соответствии с их степенью окисления. Однако, существуют и другие степени окисления, для которых используются дополнительные названия. Также, для более сложных оксидов существует система римских цифр, которая позволяет указать степень окисления конкретных элементов в оксиде.
Классификация оксидов по видам
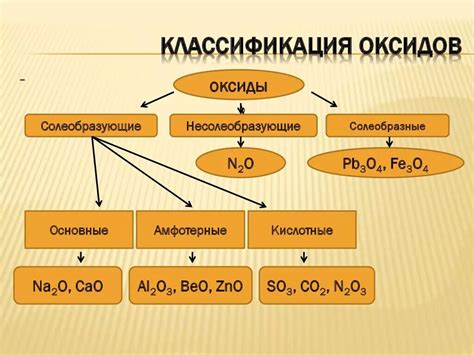
Существуют различные виды оксидов, включая:
- Металлические оксиды – это соединения, в которых кислород соединен с металлом. Они часто обладают химической активностью и способностью взаимодействовать с другими веществами. Примеры металлических оксидов включают оксид железа (Fe2O3), оксид алюминия (Al2O3) и оксид меди (CuO).
- Неметаллические оксиды – это соединения, в которых кислород соединен с неметаллом. Они обычно обладают кислотными свойствами и реагируют с щелочами, образуя соли. Примеры неметаллических оксидов включают диоксид углерода (CO2), азотистый оксид (NO) и диоксид серы (SO2).
- Кислородные оксиды – это оксиды, в которых кислород имеет положительную степень окисления. Они могут обладать как кислотными, так и основными свойствами в зависимости от условий. Примеры кислородных оксидов включают пероксид водорода (H2O2), пероксид бария (BaO2) и триоксид марганца (Mn2O3).
Классификация оксидов по их видам позволяет лучше понять их химические свойства, реактивность и применение в различных областях науки и промышленности.



