В исследованиях в области генетики и молекулярной биологии огромное значение имеет определение веса ДНК - основного нуклеинового кислотного полимера, содержащего генетическую информацию организмов. Вес ДНК может быть определен различными методами с использованием разных подходов и техник. В данной статье мы рассмотрим несколько существующих методов определения веса ДНК и их особенности.
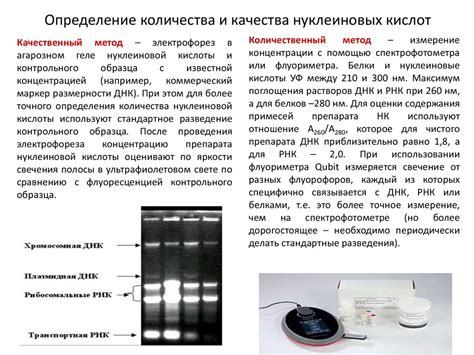
Одним из наиболее распространенных методов определения веса ДНК является электрофорез - метод разделения молекул веществ по размерам и зарядам в электрическом поле. Для определения веса ДНК с помощью электрофореза обычно используют агарозный гель, в котором проводят разделение молекул ДНК. После применения электрофореза и окрашивания геля, полученное изображение помогает определить вес ДНК. Однако этот метод имеет некоторые ограничения, связанные с точностью и надежностью определения веса ДНК.
Другим методом определения веса ДНК является спектрофотометрия - метод измерения оптической плотности образца при различных длинах волн. Для определения веса ДНК с помощью спектрофотометрии используются волны в УФ-области спектра, так как молекулы ДНК абсорбируют ультрафиолетовое излучение. Рассмотрение абсорбционного спектра позволяет определить концентрацию и вес длинных молекул ДНК. Однако из-за необходимости использования высокочувствительных инструментов и специальных реагентов, этот метод может быть более сложным и дорогостоящим.
Метод флуоресценции на основе цитометрии проточной клеток

Преимуществом этого метода является его способность анализировать большое количество клеток за короткое время. Это позволяет получить статистически значимые результаты и провести обширные исследования.
Принцип работы метода заключается в том, что ДНК в клетках окрашивается специальными флуорохромами, которые светятся под воздействием определенной длины волны света. Затем, клетки пропускаются через поток жидкости в проточной камере, их флуоресцентное излучение регистрируется фотодетекторами.
По анализу изменений интенсивности флуоресценции, можно получить информацию о весе ДНК в каждой из проточных клеток. Благодаря этому, метод флуоресценции обеспечивает точные и количественные измерения, позволяющие определить гомогенность или гетерогенность популяции клеток по весу ДНК.
Важно отметить, что для проведения такого анализа необходимо использовать специализированные аппараты - проточные цитометры. Они обеспечивают высокую чувствительность и точность измерений, а также автоматический сбор данных для последующего анализа.
Метод флуоресценции на основе цитометрии проточной клеток находит широкое применение в различных областях науки и медицины, включая исследования клеточной генетики, онкологии, а также контроль качества и отбор клеток в биотехнологических процессах. Его преимущество в скорости и точности анализа делает его неотъемлемым инструментом для изучения биологических систем и процессов, связанных с ДНК.
Секвенирование ДНК методом Sanger

Основной принцип метода Sanger заключается в синтезе комплементарных нитей ДНК с применением дидезоксинуклеотидов (ddNTP). В процессе реакции секвенирования добавляются обычные дезоксинуклеотиды (dNTP) и дидезоксинуклеотиды, которые являются блокирующими и прерывают синтез нити ДНК. Для каждого из четырех типов нуклеотидов (A, T, G, C) используются ddNTP соответствующего типа. При выполнении секвенирования получается набор фрагментов ДНК разной длины, отсортированных по размеру.
Далее эти фрагменты ДНК разделяются с помощью электрофореза в геле, где каждый фрагмент мигрирует в зависимости от своего размера. Затем происходит детектирование миграционных пиков с использованием флуоресцентных меченых примесей, прикрепленных к последнему нуклеотиду фрагмента ДНК. Результатом секвенирования является электрофореграмма, на которой отображаются пики соответствующие каждому нуклеотиду.
Для анализа электрофореграммы и определения последовательности ДНК используется специальное программное обеспечение. Автоматические секвенаторы позволяют проводить секвенирование высокой скоростью и получать результаты в электронном виде.
Метод Sanger является точным и надежным, однако имеет некоторые ограничения. Основным ограничением является длина прочитываемого фрагмента ДНК, которая составляет примерно 500-1000 нуклеотидов. Кроме того, процесс секвенирования требует специального оборудования и высокой степени автоматизации для обработки больших объемов данных.
Секвенирование методом Sanger является одним из основных инструментов молекулярной биологии и генетики и широко применяется в медицинских и научных исследованиях, а также для решения генетических задач в практической медицине.
Электрофорез ДНК

Принцип электрофореза ДНК основан на различии в электрической подвижности фрагментов ДНК. Заряженные фрагменты ДНК перемещаются под воздействием электрического поля через гель (обычно агарозный или полиакриламидный гель), который служит в качестве сортирующей матрицы.
Во время электрофореза ДНК, электрическое поле создается между двумя электродами, один из которых находится на начале геля, а другой - на его конце. ДНК образцы, предварительно подготовленные и обработанные, наносятся на начало геля.
Под действием электрического поля, фрагменты ДНК начинают перемещаться по гелю. Маленькие фрагменты передвигаются быстрее, чем большие, поскольку они могут более легко проникать в поры геля. Как результат, фрагменты ДНК разделяются на основе их размера, исходя от самых маленьких к самым большим.
Полимеразная цепная реакция (ПЦР)
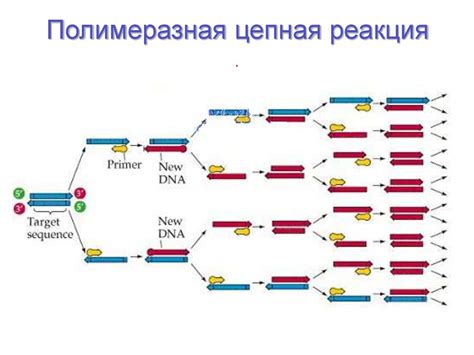
Основная идея ПЦР заключается в чередовании нескольких температурных циклов, при которых происходит разделение, связывание и расширение целевой ДНК. Процесс ПЦР основан на действии ферментов ДНК-полимеразы, которые катализируют синтез новой ДНК по матричной ДНК.
Основные этапы ПЦР:
| Этап | Температура (°C) | Действие |
|---|---|---|
| Денатурация | 95 | Распад двухцепной ДНК на две одноцепочечные |
| Отжиг праймеров | 50-65 | Связывание праймеров с комплементарной матричной ДНК |
| Экстенсия/продление | 72 | Синтез новой ДНК цепи при помощи ДНК-полимеразы |
ПЦР широко используется в научных исследованиях, медицине, судебно-медицинской экспертизе и других областях. Она позволяет быстро и точно определить наличие и количество конкретных ДНК-фрагментов в образце, что имеет большое значение в диагностике различных заболеваний, идентификации организмов и патернитетного анализа.
Спектрофотометрический метод определения ДНК
ДНК поглощает УФ-излучение с длиной волны около 260 нм. При определенных условиях, уровень поглощения УФ-излучения пропорционален концентрации ДНК в растворе. Измерение поглощения производится с помощью спектрофотометра.
Для измерения поглощения длины волны УФ-излучения, спектрофотометр использует специальную прозрачную кювету, куда помещается раствор ДНК. УФ-излучение проходит через кювету, и его поглощение измеряется детектором в спектрофотометре.
На основе измеренных значений поглощения и известного коэффициента экстинкции для ДНК при 260 нм (пропорционального концентрации ДНК), можно рассчитать концентрацию ДНК в растворе. Для этого используется формула Бирнштейна:
Концентрация ДНК (мкг/мл) = (A * df) / (d * e)
где A - поглощение при 260 нм, df - коэффициент дилуции, d - толщина кюветы в см, e - коэффициент экстинкции ДНК при 260 нм.
| Преимущества | Недостатки |
|---|---|
| Простота и скорость измерений | Метод требует чистой и концентрированной ДНК |
| Относительная недорогая стоимость оборудования | Возможность ошибки при определении толщины кюветы и коэффициента экстинкции |
| Высокая точность результатов | Чувствительность к примесям и образованию агрегатов ДНК |
Спектрофотометрический метод определения ДНК широко используется в молекулярной биологии и генетике для качественного и количественного анализа ДНК, а также для контроля чистоты и концентрации ДНК перед проведением экспериментов.