Молекулы вещества - основные строительные блоки всех материальных объектов в нашем мире. Они образуются благодаря связям между атомами, которые могут быть очень разнообразными. Связи между атомами определяют структуру и свойства вещества, влияют на его фазовые переходы, реактивность и взаимодействие с другими веществами.
Одна из самых распространенных связей между атомами - ковалентная связь. Ковалентная связь образуется при совместном использовании электронов оболочки несколькими атомами. Одиночная ковалентная связь образуется при совместном использовании одной пары электронов, двойная связь - при использовании двух пар электронов, а тройная связь - при использовании трех пар электронов. Ковалентная связь позволяет атомам быть стабильными и образовывать различные молекулы, такие как вода, углекислый газ и многое другое.
Однако существуют и другие типы связей между атомами. Ионная связь возникает, когда один атом отдает или получает электрон(ы) у другого атома. В результате образуется положительный и отрицательный ион, которые притягиваются друг к другу. Ионная связь присутствует, например, в соли, где положительные ионы металла притягивают отрицательные ионы неметалла.
Еще одним типом связи между атомами является металлическая связь. Она характерна для металлов и основана на свободном передвижении электронов между атомами. Металлическая связь обеспечивает металлам такие свойства, как высокая электропроводность и теплопроводность, гибкость и прочность.
Принцип связи атомов в молекулы

Принцип связи атомов базируется на том, что атомы стремятся достичь электронной конфигурации, аналогичной инертным газам, таким как гелий или неон. Для этого атомы образуют связи, в результате чего образуется молекула.
Связи между атомами можно классифицировать по типам электронного обмена: ионная связь, ковалентная связь и металлическая связь.
Ионная связь образуется при переносе электронов от одного атома к другому, создавая положительно и отрицательно заряженные ионы, которые притягиваются друг к другу. Примером ионных связей является связь между натрием (Na) и хлором (Cl) в соли.
Ковалентная связь возникает, когда два атома делят одну или несколько пар электронов. Ковалентные связи бывают полярными (если электроотрицательность атомов различна и создается разность зарядов) и неполярными (если электроотрицательность атомов одинакова). Примером ковалентного связывания является связь между двумя атомами водорода (H2).
Металлическая связь возникает в металлах, где электроны свободно передвигаются между атомами, создавая электронное облако. Примером металлической связи является связь между атомами меди (Cu) в металлическом проводнике.
| Тип связи | Пример |
|---|---|
| Ионная связь | NaCl (соль) |
| Ковалентная связь | H2 (водород) |
| Металлическая связь | Cu (медь) |
Атомы: строительные кирпичики вещества
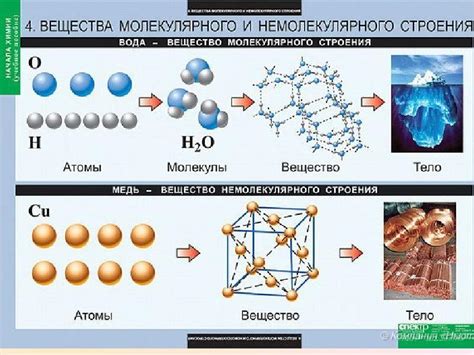
Атомы объединяются между собой, образуя молекулы. Взаимодействие атомов и их связи определяют физические и химические свойства вещества.
Когда атомы объединяются, возникают силы связи. Они могут быть ковалентными, ионными или металлическими, в зависимости от типа атомов и режима их взаимодействия.
Ковалентные связи образуются, когда атомы делят пару электронов друг с другом, образуя молекулу. Это типично для неметаллических элементов.
Ионные связи возникают, когда атомы передают или принимают электроны, образуя ионы, которые притягиваются друг к другу благодаря противоположным зарядам. Это стандартный пример взаимодействия металлов и неметаллов.
Металлические связи характеризуются общими электронами, которые свободно перемещаются между атомами металлов. Это обеспечивает хорошую проводимость электричества и тепла.
Атомы вещества могут быть упорядочены по различным способам. Некоторые вещества образуют кристаллическую решетку, где атомы расположены в определенном порядке. Другие вещества могут быть аморфными, где атомы располагаются более беспорядочно.
Важно отметить, что будучи по отдельности, атомы имеют различные свойства, чем объединенные в молекулы. Таким образом, связи между атомами играют важную роль в определении свойств вещества и его поведения.
| Тип связи | Примеры веществ |
|---|---|
| Ковалентные связи | Сахар (C12H22O11), вода (H2O) |
| Ионные связи | Соль (NaCl), карбонат (CaCO3) |
| Металлические связи | Ферромагнитные металлы, такие как железо (Fe) и никель (Ni) |
Связь атомов: ключевой процесс образования молекул
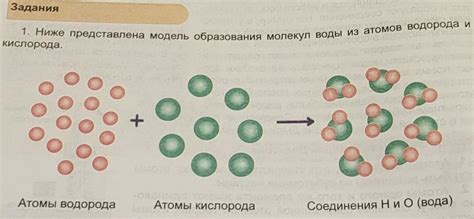
Основными типами химических связей являются ковалентная и ионная связи. В ковалентной связи атомы обменивают электроны, создавая общие электронные пары. Такая связь образуется между неметаллами и создает довольно сильные связи между атомами, что делает молекулы стабильными.
Ионная связь образуется между атомами металлов и неметаллов. В этом случае один атом отдает электроны, становясь положительно заряженным ионом, а другой атом получает электроны, становясь отрицательно заряженным ионом. Такие ионы притягиваются друг к другу и образуют кристаллическую решетку.
Еще одним важным процессом образования молекул является межмолекулярное взаимодействие. Это взаимодействие происходит между различными молекулами и играет важную роль в свойствах вещества. Например, водородные связи между молекулами воды обусловливают ее высокую кипящую температуру и плотность в твердом состоянии.
| Тип связи | Описание |
|---|---|
| Ковалентная связь | Атомы обменивают электроны, создавая общие электронные пары |
| Ионная связь | Атомы образуются отдают или получают электроны, образуя положительно и отрицательно заряженные ионы |
| Межмолекулярное взаимодействие | Взаимодействие между различными молекулами, например, водородные связи |
Понимание процесса образования молекул и связей между атомами является фундаментальным для химии и позволяет предсказывать свойства и реакции вещества. Это позволяет ученым разрабатывать новые материалы с желаемыми свойствами и использовать их в различных областях науки и технологий.
Ковалентная связь: общая основа молекулярного строения
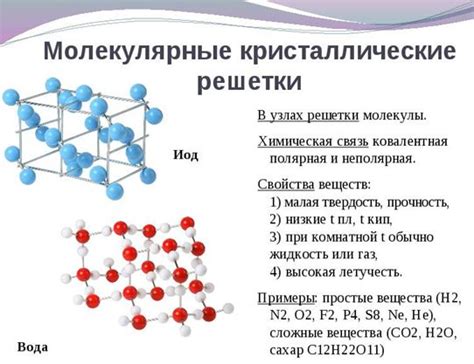
Ковалентная связь образуется, когда два атома делят пару электронов между собой. Электроны образуют общий электронный облако, которое окружает оба атома. Таким образом, образуется молекула, состоящая из двух или более атомов, связанных между собой ковалентной связью.
Ковалентная связь может быть одиночной, двойной или тройной в зависимости от числа электронных пар, которые делятся между атомами. В одиночной связи атомы делят одну электронную пару, в двойной - две пары, а в тройной - три пары.
Ковалентная связь играет ключевую роль в определении физических и химических свойств вещества. Она влияет на плотность, температуру плавления и кипения, теплоемкость, электропроводность и многие другие свойства вещества. Кроме того, ковалентная связь основа для образования различных соединений и молекул огромного количества веществ, включая органические соединения.
- Ковалентная связь образует структуры, которые определяют свойства молекулы.
- Электроны в ковалентной связи образуют общее электронное облако.
- Использование электронов внешней оболочки атомов обеспечивает устойчивость молекулы.
- Одиночная, двойная и тройная связи представляют разные уровни электронной плотности между атомами.
Ионная связь: как заряды привлекаются и образуют структуру

Ионная связь образуется благодаря притяжению между зарядами разных знаков. Катионы, обладающие положительным зарядом, притягивают анионы, обладающие отрицательным зарядом. Эта притяжение создает кристаллическую структуру вещества, состоящую из упорядоченной сети ионов, называемой решеткой.
Ионная связь является очень прочной и образуется между атомами, которые имеют большую разницу в электроотрицательности. Электроотрицательность – это способность атома притягивать электроны к себе. Атомы с маленькими электроотрицательностями обычно становятся катионами, а атомы с большими электроотрицательностями – анионами. Чем больше разница в электроотрицательности между атомами, тем сильнее ионное взаимодействие и тем прочнее будет ионная связь между ними.
Ионные соединения обладают рядом особенностей, например, они обычно образуют кристаллические структуры, имеют высокую температуру плавления и обладают хорошей проводимостью электричества в растворе или в расплавленном состоянии.
Важно отметить, что ионная связь играет важную роль в мире химии и определяет свойства многих веществ. Например, ионная связь присутствует в многих солевых соединениях и составляет основу электролитических реакций.
Металлическая связь: секрет прочности металлов

Металлическая связь возникает из-за особого строения атомов в металлической решетке. В металлах атомы располагаются в регулярном кристаллическом строении, образуя так называемую металлическую решетку. Каждый атом в металле отдает один или несколько своих электронов в общий электронный газ. Таким образом, электроны становятся общедоступными и свободно перемещаются по всей решетке металла.
Именно благодаря этому перемещению электронов металлы обладают своей особой структурой и свойствами. Металлическая связь сильная, что обеспечивает прочность металлов и их высокую теплопроводность и электропроводность.
Важно отметить, что металлическая связь также ответственна за характерные светящиеся и блестящие свойства металлов, так как электроны, которые свободно двигаются по металлической решетке, могут поглощать и излучать энергию в видимом спектре.
Металлическая связь играет важную роль в различных сферах нашей жизни. Благодаря ей мы имеем возможность создавать прочные и долговечные металлические конструкции, такие как здания, мосты и машины. Также металлы широко используются в медицине и электронике благодаря своим уникальным свойствам.
Водородная связь: слабая, но важная составляющая молекул
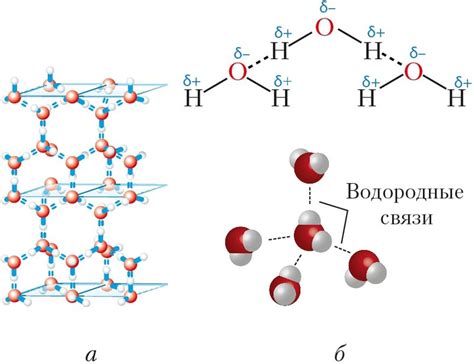
Водородная связь формируется между атомами водорода и такими электроотрицательными атомами, как кислород, азот или фтор. Электроотрицательный атом притягивает электроны, образуя так называемую полярную связь. В результате образуется слабая еловая связь между водородом и электроотрицательным атомом.
| Вещество | Химическая формула | Примеры |
|---|---|---|
| Вода | H2O | Молекула воды состоит из двух атомов водорода, связанных с атомом кислорода. Водородные связи между молекулами воды обусловливают ее уникальные физические и химические свойства, такие как высокая теплота парообразования и поверхностное натяжение. |
| Аммиак | NH3 | Молекула аммиака содержит один атом азота, связанный с тремя атомами водорода. Водородные связи в молекуле аммиака обусловливают его способность к образованию водородных связей со смежными молекулами и водой. |
| ДНК | высокомолекулярная | В молекуле ДНК, двух спиральных цепей, каждая из которых состоит из нуклеотидов, связываются водородными связями между комплементарными парными основаниями. Такая структура ДНК позволяет ей хранить и передавать генетическую информацию. |
Водородные связи являются важным фактором в системах живых организмов, так как способствуют формированию белковой и нуклеиновой кислотной структур, что позволяет им выполнять свои функции. Также водородные связи играют важную роль в физических свойствах воды и других жидкостей.