Химия – увлекательный предмет, изучение которого позволяет узнать много интересного о строении вещества и его взаимодействии. Восьмой класс – это время, когда учащиеся начинают знакомиться с основными понятиями и законами химии. На одном из уроков вы обязательно столкнетесь с расчетом массы газа. Этот расчет основан на применении закона Авогадро и основных химических формул.
Итак, как найти массу газа в химии?
Сперва необходимо знать молярную массу газа, то есть массу одного моля вещества. Молярная масса может быть найдена в химических таблицах или вычислена через атомные массы элементов, из которых состоит газ. После этого, необходимо определить количество молей газа, используя объем газа и его плотность.
Основные понятия химии

Вещество – это любая материя, которая имеет массу и занимает определенный объем пространства.
Атом – минимальная частица вещества, обладающая его химическими свойствами.
Молекула – частица, образованная двумя или более атомами, связанными химической связью.
Элемент – вещество, состоящее только из одного вида атомов. Всего на Земле известно около 100 элементов.
Соединение – это вещество, образованное соединением атомов двух или более различных элементов.
Химическая реакция – процесс превращения одних веществ в другие под воздействием различных факторов, таких как теплота, свет или электричество.
Масса – количественная характеристика вещества, определяющая его количество материи.
Газ – одно из состояний вещества, при котором его молекулы находятся в хаотическом движении и заполняют все доступное им пространство.
Моль – единица измерения количества вещества, равная числу атомов или молекул в 12 граммах углерода-12.
Тепловой эффект – избыточная или недостаточная энергия, выделяющаяся или поглощаемая во время химической реакции.
Катализатор – вещество, ускоряющее химическую реакцию, но не участвующее в ней самостоятельно.
Реакционная способность – способность вещества образовывать новые вещества в результате взаимодействия с другими веществами.
Способы измерения массы газа

Один из наиболее распространенных способов измерения массы газа - это использование газовых капель или шариков, которые имеют известную массу. Они могут быть изготовлены из разных материалов, например, стекла или металла. Для измерения массы газа, капли или шарики погружаются в газовую среду, и затем измеряются изменения их массы. Этот метод применяется, например, для измерения массы газа, получаемого при химической реакции.
Еще одним способом измерения массы газа является использование газовых баллонов или цилиндров, которые имеют известный объем. Газ набирается в баллон до достижения требуемого объема, и затем измеряется масса баллона с газом. Путем вычитания массы пустого баллона можно определить массу газа. Этот метод часто используется в промышленности для контроля и измерения объема газа.
Другим способом измерения массы газа является применение газовых масок или аппаратов для дыхания. Эти устройства имеют специальные баллоны, которые содержат газ или смесь газов заданной массы. Путем измерения изменения массы баллона до и после использования, можно определить массу потребленного газа. Этот метод применяется во многих областях, например, при работе с опасными газами или в медицинских целях.
Таким образом, существует несколько способов измерения массы газа, каждый из которых подходит для определенных условий и задач. Измерение массы газа требует точности и аккуратности, а также учета различных факторов, влияющих на результаты измерений.
Закон сохранения массы газа

В химии существует важный закон, называемый законом сохранения массы газа. Согласно этому закону, масса газа, участвующего в химической реакции, не может ни увеличиваться, ни уменьшаться. Она остается неизменной на протяжении всей реакции.
Другими словами, если в начале реакции суммарная масса реагирующих веществ была равна, то и в конце реакции суммарная масса образовавшихся продуктов будет равна. Это означает, что при химических превращениях происходит только перераспределение массы.
Закон сохранения массы газа можно иллюстрировать на примере одной из наиболее известных химических реакций - горения. Когда горит кусок древесины, он переходит в углекислый газ и воду. Мы можем заметить, что в начале масса древесины была больше, чем масса продуктов сгорания. Однако, суммарная масса продуктов все равно будет равна массе древесины, так как масса не может исчезнуть.
Закон сохранения массы газа имеет большое значение в химических расчетах и позволяет предсказывать результаты химических реакций. Он помогает химикам и инженерам оптимизировать процессы и обеспечивает надежность химических производств.
Формула для вычисления массы газа
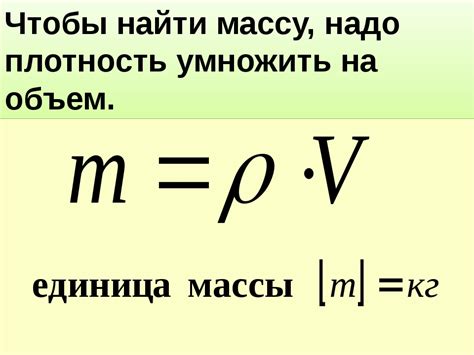
В химии существует формула, позволяющая вычислить массу газа. Для этого необходимо знать его объем и плотность. Формула для расчета массы газа выглядит следующим образом:
| Масса газа (м) | = | Объем газа (V) | × | Плотность газа (ρ) |
Однако для правильного расчета массы газа необходимо учесть единицы измерения. Объем газа обычно измеряется в литрах (л), а плотность газа - в граммах на литр (г/л). Поэтому для получения массы газа в граммах (г) необходимо выполнить следующую последовательность действий:
- Перевести объем газа из литров в кубические сантиметры (1 л = 1000 см³).
- Умножить полученное значение объема в кубических сантиметрах на плотность газа в граммах на литр.
Таким образом, для вычисления массы газа нужно учитывать как объем газа, так и его плотность.
Практические примеры расчета массы газа

Расчет массы газа может быть не только теоретическим заданием в учебнике, но и иметь практическое применение в реальной жизни. Ниже представлены два практических примера расчета массы газа, которые помогут уяснить и закрепить материал по данной теме.
Пример 1: Расчет массы газа в воздухе
Представим ситуацию, когда вам необходимо узнать массу газа в воздухе в определенном объеме. Известно, что средняя плотность воздуха составляет около 1,2 кг/м³. Допустим, вы хотите узнать массу газа в объеме 5 м³:
Масса газа = Плотность газа × Объем газа
Масса газа = 1,2 кг/м³ × 5 м³ = 6 кг
Таким образом, в 5 м³ воздуха будет содержаться около 6 кг газа.
Пример 2: Расчет массы углекислого газа в газовом баллоне
Давайте представим, что у вас есть газовый баллон объемом 10 л и вы хотите узнать массу содержащегося в нем углекислого газа. Для этого необходимо знать молярную массу углекислого газа, которая равна примерно 44 г/моль:
Масса газа = Молярная масса газа × Количество вещества газа
Количество вещества газа можно вычислить с помощью уравнения Гей-Люссака (для комплексных задач рассчета с учетом температуры и давления) или использовать уравнение состояния идеального газа (для простых задач при нормальных условиях наблюдения):
PV = nRT
где P - давление газа, V - объем газа, n - количество вещества газа, R - универсальная газовая постоянная, T - температура газа в Кельвинах.
Предположим, что в газовом баллоне давление составляет 2 атмосферы, а температура 300 Кельвинов:
Масса газа = 44 г/моль × Количество вещества газа
Из уравнения состояния идеального газа получаем:
2 атм × 10 л = (n × 0,0821 л × атм/моль × к) × 300 K
n = 0,013 моль
Теперь, зная количество вещества газа, мы можем рассчитать массу:
Масса газа = 44 г/моль × 0,013 моль = 0,572 г
Таким образом, в газовом баллоне объемом 10 л содержится около 0,572 г углекислого газа.
Следуя аналогичным принципам расчета, можно определить массу газа для других веществ или в других условиях. Практиковать эти примеры поможет лучше понять, как использовать формулы для расчета массы газа.



