Водород – это один из самых распространенных элементов во Вселенной. Он обладает наименьшей атомной массой и самым простым строением, состоящим из всего одного протона и одного электрона. Основной источник водорода на Земле - вода, поэтому иногда его называют "водным газом".
Водород может образовывать различные химические соединения, включая воду, метан, аммиак и многие другие. Однако одним из наиболее удивительных особенностей водорода является его способность принимать ионный заряд. В этом случае водород получает отрицательную степень окисления, что делает его очень реактивным и способным образовывать различные типы связей.
Отрицательная степень окисления водорода имеет важное значение для таких процессов, как электролиз воды, производство водорода как топлива и его использование в различных химических реакциях. Благодаря своей высокой реактивности и способности образовывать связи с другими элементами, водород играет ключевую роль в нескольких отраслях науки и промышленности, включая энергетику, химию и космическую технологию.
Когда водород имеет отрицательную степень окисления?

Водород обычно имеет положительную степень окисления (+1), так как теряет свой единственный электрон в химических реакциях. Однако, под влиянием некоторых факторов, водород может приобретать отрицательную степень окисления (-1).
Основными ситуациями, когда водород имеет отрицательную степень окисления, являются:
- Соединения с металлами из группы 1 и 2: водород образует сильные водородные иометаллические связи с металлами из группы 1 (например, литий, натрий) и группы 2 (например, магний, кальций). В таких соединениях, водород приобретает отрицательную степень окисления (-1).
- Химические соединения с бором: в соединениях водорода с бором (например, бораны), водород имеет отрицательную степень окисления (-1) из-за их особенной структуры и электронного строения.
- В процессе реакций с некоторыми неметаллами: водород может иметь отрицательную степень окисления в реакциях с некоторыми неметаллами, такими как кислород, фтор, хлор и другие. В таких реакциях, водород участвует в образовании отрицательно заряженных ионов.
Знание о возможности отрицательной степени окисления водорода является важным для понимания и прогнозирования химических реакций, а также для разработки новых материалов и соединений с уникальными свойствами.
Водород и его свойства

У водорода есть несколько уникальных свойств, которые делают его особенным. Во-первых, водород обладает очень низкой плотностью, что делает его идеальным материалом для использования в легких и высокоэффективных технологиях, таких как водородные топливные элементы. Во-вторых, водород имеет очень широкий диапазон температур, при которых он может существовать в жидком, газообразном и твердом состояниях. Это делает его удобным для использования в различных отраслях науки и промышленности.
Одним из самых важных свойств водорода является его отрицательная степень окисления. Это означает, что водород может принимать на себя электроны от других элементов, что делает его отличным восстановителем. Это свойство широко используется в различных процессах, таких как производство синтетических удобрений или очистка промышленных выбросов.
Окисление и степень окисления
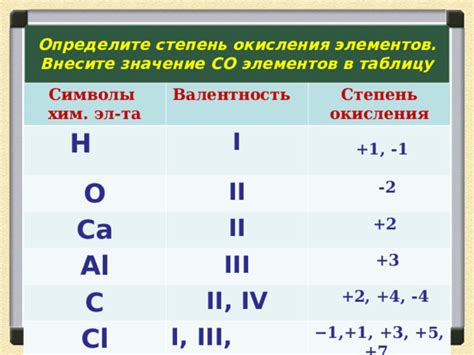
Степень окисления – это численное значение, которое указывает, сколько электронов вещество теряет или приобретает при окислении или восстановлении. Водород имеет степень окисления +1, когда он теряет электрон и становится положительно заряженным ионом. Однако, в некоторых соединениях, водород может иметь степень окисления -1.
Отрицательная степень окисления водорода встречается, когда он приобретает электроны, образуя гидрид. Гидриды водорода широко используются в различных химических реакциях и являются важными соединениями в промышленности и научных исследованиях.
Знание степени окисления водорода помогает ученым понять химические реакции и процессы, в которых он участвует. Это также важно для определения свойств соединений, каталитических реакций, а также для разработки новых материалов и технологий, связанных с использованием водорода.
Отрицательная степень окисления водорода

Отрицательная степень окисления водорода означает, что атом водорода получает электроны и становится ионом с отрицательным зарядом. Такие ионы, известные как гидриды, играют важную роль во многих химических реакциях и процессах в природе и промышленности.
Гидриды водорода обладают высокой реакционной способностью и широким спектром применения. Они используются в процессах водородации, в которых переходит насыщение углеродных соединений в более простые и стабильные соединения. Также гидриды водорода применяются в качестве катализаторов в различных химических процессах и в производстве различных химических веществ.
Более того, отрицательная степень окисления водорода играет важную роль в биологических процессах. Например, водород в отрицательной степени окисления является ключевым компонентом в биохимическом процессе ферментативного дыхания, который позволяет организмам получать энергию из пищи.
Таким образом, отрицательная степень окисления водорода имеет большое значение в различных областях науки и технологии. Изучение и использование гидридов водорода позволяет нам развивать новые и эффективные пути синтеза химических соединений, создавать новые материалы и расширять наши знания о фундаментальных принципах химии и биологии.
Зачем важна отрицательная степень окисления?

Отрицательная степень окисления водорода играет важную роль во многих химических реакциях. Она позволяет водороду принимать на себя электроны и проявлять свои редокс-свойства. Это означает, что водород может служить оокислителем, передавая электроны другим веществам.
Отрицательная степень окисления водорода встречается, например, в соединениях с неметаллами, такими как кислород, фтор и азот. Эти соединения, такие как вода (H2O), диоксид углерода (CO2) и аммиак (NH3), имеют важное значение для многих жизненно важных процессов.
Вода, например, является основной составляющей всех живых организмов и играет важную роль в биологических реакциях. Отрицательное окисление водорода в молекуле воды позволяет ей служить источником электронов в ряде ферментативных реакций, необходимых для производства энергии и синтеза веществ.
Аммиак, в свою очередь, является важным источником азота для растений и животных. Отрицательная степень окисления водорода в молекуле аммиака позволяет ему легко вступать в реакцию с другими веществами и обеспечивать азотом живые организмы.
Таким образом, отрицательная степень окисления водорода играет фундаментальную роль во многих химических, биологических и экологических процессах. Она дает водороду возможность проявлять свои уникальные свойства и участвовать в разнообразных реакциях, которые являются основой жизненной активности нашей планеты.
Механизмы образования отрицательной степени окисления

Отрицательная степень окисления атома водорода может возникать в различных химических процессах. Это означает, что водород обретает дополнительные электроны и становится ионообразным компонентом, электронным донором или сердцевиной восстановительной реакции.
Один из механизмов образования отрицательной степени окисления водорода – это анионная трансформация, когда водород прикрепляется к электронной паре в молекуле или ионе. В результате образуется новый анион с отрицательной степенью окисления водорода.
Другой механизм – это катионная трансформация, которая происходит, когда водород присоединяется к атомам или ионам, у которых уже отрицательная степень окисления. Водородные катионы могут играть важную роль в биохимических процессах, так как они способны переносить протоны через клеточные мембраны или участвовать в реакциях окисления-восстановления.
Еще одним механизмом образования отрицательной степени окисления водорода является водородная аддиция – реакция, при которой водород присоединяется к двойной или тройной связи органической молекулы. Это важный процесс, который происходит во многих химических реакциях, таких как гидрогенирование и ферментативный обмен веществ в клетках организмов.
Кроме того, отрицательная степень окисления водорода может возникать в электролитических реакциях, когда водород реагирует с отрицательно заряженными частицами в растворе. Например, при электролизе воды водород выделяется на катоде, увеличивая свою отрицательную степень окисления.
Понимание механизмов образования отрицательной степени окисления водорода является важным для понимания многих химических и биохимических процессов. Изучение этих процессов позволяет углубить наши знания о реакционных механизмах и применить их в различных областях науки и техники, таких как каталитическое превращение водорода, энергетика и медицина.
Роли водорода с отрицательной степенью окисления

Водород с отрицательной степенью окисления играет важную роль во многих процессах и реакциях в природе и промышленности.
Одной из основных ролей водорода с отрицательной степенью окисления является его участие в биологических реакциях. Например, водород с негативным зарядом присутствует в процессе дыхания, где он служит переносчиком электронов в митохондриях клеток. Также водород с отрицательной степенью окисления участвует в процессе фотосинтеза, где он преобразуется в энергию и используется для создания органических соединений.
В промышленности водород с отрицательной степенью окисления также имеет важное значение. Он широко используется в процессе производства аммиака, который является основным компонентом азотных удобрений. Кроме того, водород с негативным зарядом применяется в процессе получения водородных пылей и металлов методом электролиза, а также в производстве ряда химических веществ и материалов.
Водород с отрицательной степенью окисления также находит применение в энергетике. Он используется в топливных элементах, где преобразуется в воду, выделяя энергию. Такие топливные элементы могут быть использованы в различных областях, включая автомобильную и космическую промышленность, что делает водород с отрицательной степенью окисления перспективным альтернативным источником энергии.
Кроме того, водород с отрицательной степенью окисления играет роль в аналитической химии. Он используется в качестве редокс-индикатора, изменяющего свою окраску при изменении степени окисления. Это позволяет определять концентрацию и состояние окисления вещества в химическом анализе.
Таким образом, водород с отрицательной степенью окисления играет неотъемлемую роль в различных сферах нашей жизни, от биологии до энергетики, и имеет большой потенциал для развития и инноваций в будущем.
Использование отрицательной степени окисления в промышленности

В промышленности отрицательная степень окисления водорода находит применение во многих областях:
- Производство аммиака: Водород с отрицательной степенью окисления используется в процессе синтеза аммиака. Водород служит редукционным агентом для окисления азота, что позволяет получить аммиак в промышленных масштабах.
- Производство металлов: Отрицательная степень окисления водорода позволяет использовать его в процессе получения некоторых металлов, таких как железо и никель, из их руд. Водород действует как редукционный агент, способствуя снижению окислительной способности соединений металлов.
- Производство воды: Отрицательная степень окисления водорода применяется в процессе производства воды путем электролиза. При применении электрического тока водород и кислород из воды разделяются, что позволяет получить чистую воду. Водород служит в данном процессе как высокоэффективный редукционный агент.
Таким образом, использование отрицательной степени окисления водорода в промышленности является важным и необходимым для ряда процессов. Это открывает возможности для эффективного производства материалов и веществ необходимых в различных отраслях промышленности.
- Реактивность: Отрицательная степень окисления водорода обозначает высокую электронную плотность в молекуле, что делает его очень реакционноспособным. Водород с отрицательной степенью окисления может участвовать во многих реакциях, например, восстанавливаться или образовывать ковалентные связи с другими элементами.
- Транспорт энергии: Отрицательная степень окисления водорода позволяет ему служить важным переносчиком энергии в клетках организмов. Водород с отрицательной степенью окисления участвует в процессах, связанных с образованием и использованием энергетических молекул, таких как АТФ.
- Синтез и разложение веществ: Отрицательная степень окисления водорода играет важную роль в химических процессах синтеза и разложения веществ. Водород с отрицательной степенью окисления может использоваться для синтеза органических соединений и разложения сложных молекул.
- Перенос электронов: Водород с отрицательной степенью окисления способен эффективно переносить электроны. Этот процесс важен для многих биологических реакций, таких как дыхание растений и животных.
Все эти факторы демонстрируют важность отрицательной степени окисления водорода в различных химических и биологических процессах. Понимание и учет этой химической характеристики водорода помогает улучшить наши знания о его свойствах и использовать его потенциал в разных областях науки и технологий.