Динамическое равновесие пара и жидкости – это состояние, когда количество испарившегося пара равно количеству обратно конденсированного пара. Такое равновесие возникает при определенных условиях и играет важную роль в различных процессах, связанных с фазами вещества.
Ключевой фактор, определяющий установление динамического равновесия, – это разница в парциальном давлении пара и давлении жидкости. Когда давление пара достигает насыщения, парциальное давление достигает установившегося значения, и начинается процесс конденсации. В то же время, если давление пара ниже насыщения, происходит испарение из жидкости.
Установление динамического равновесия пара и жидкости может быть наблюдаемо в жизненных ситуациях, например, когда мы наблюдаем конденсацию водяного пара на стекле или зеркале в горячей ванной комнате. Также это равновесие играет важную роль в промышленности, особенно в процессах, связанных с перегонкой, выпариванием и конденсацией жидкостей.
Определение динамического равновесия пара и жидкости
Определение динамического равновесия пара и жидкости играет важную роль в физической химии и инженерии. При этом учитываются температура, давление и другие факторы, которые влияют на процессы испарения и конденсации.
Пар и жидкость могут находиться в динамическом равновесии при определенных условиях, например, при определенной температуре и давлении. В этом состоянии пар превращается в жидкость и наоборот с одинаковой интенсивностью, что приводит к стабильности концентраций пара и жидкости.
Определение динамического равновесия пара и жидкости является основой для различных технологических и промышленных процессов, связанных с испарением и конденсацией. Использование этого параметра позволяет контролировать процессы перехода фазы пар-жидкость и обеспечить стабильность работы системы.
Концепция динамического равновесия

В физике динамическое равновесие определяется как состояние системы, в котором наблюдается равновесие между движущимися частями системы и внешней средой. В случае пара и жидкости, динамическое равновесие возникает, когда пар воздуха и жидкость взаимодействуют таким образом, что их скорости и давления стабилизируются.
Концепция динамического равновесия в паре и жидкости основана на балансе сил и потоков массы. Когда пар воздуха и жидкость перемещаются, возникают различные силы, такие как сила тяжести, давление и трение. В динамическом равновесии эти силы компенсируются таким образом, что система остается стабильной и не меняет своего состояния со временем.
Динамическое равновесие имеет важное практическое значение в различных областях, включая гидродинамику, аэродинамику и механику жидкостей. Понимание и управление динамическим равновесием позволяют проектировать и оптимизировать системы, работающие с паром и жидкостями, такие как трубопроводы, насосы и турбины.
Основные характеристики веществ в динамическом равновесии

В динамическом равновесии вещества, находящиеся в паре и жидкости, обладают некоторыми основными характеристиками, которые важны для понимания и изучения процессов, происходящих в системе. Ниже перечислены основные характеристики веществ:
Температура - это параметр, определяющий степень нагретости или охлаждения вещества. В динамическом равновесии температура вещества может варьироваться в зависимости от внешних воздействий и внутренних процессов.
Давление - это сила, действующая на единицу площади. Вертикальное расстояние, на котором давление одного и того же вещества меняется на единицу, называется градиентом давления. В динамическом равновесии давление вещества может сохраняться или изменяться в зависимости от внешних факторов.
Плотность - это величина, характеризующая массу вещества, содержащуюся в единице объема. В динамическом равновесии плотность вещества может изменяться в зависимости от его состояния - пара или жидкости.
Важно понимать, что эти основные характеристики взаимосвязаны и могут изменяться вместе в системе вещества в динамическом равновесии. Также стоит отметить, что они могут быть влиянием внешних воздействий или изменяться в результате внутренних процессов, происходящих в системе.
Физические процессы, влияющие на установление динамического равновесия пара и жидкости

Один из таких факторов – это испарение жидкости. При повышении температуры жидкость начинает испаряться и превращаться в пар. Этот процесс осуществляется благодаря тепловому движению молекул, при котором некоторые из них обладают достаточной энергией для преодоления сил притяжения и перехода в газообразное состояние.
Другой важный фактор – это конденсация пара. Пар может конденсироваться обратно в жидкость при понижении температуры или при повышении давления. Также конденсация может происходить на поверхности твердого тела или жидкости, которые обладают достаточной адгезией к молекулам пара.
Также для установления динамического равновесия пара и жидкости необходимо учесть изменение объемов и давления. При увеличении температуры пар расширяется и его объем увеличивается. Это может привести к увеличению давления пара. В то же время, если поверхность жидкости находится под постоянным давлением, то увеличение парообразования может вызвать увеличение давления внутри контейнера.
Все эти факторы влияют на установление динамического равновесия пара и жидкости, которое происходит, когда скорость испарения равна скорости конденсации. Это равновесие может быть нарушено изменением температуры, давления или взаимодействия с другим веществом.
| Фактор | Влияние |
|---|---|
| Испарение жидкости | Увеличивает количество пара |
| Конденсация пара | Снижает количество пара |
| Изменение объемов и давления | Могут изменять количество пара и давление в системе |
Влияние внешних факторов на установление динамического равновесия

Один из основных факторов, влияющих на установление динамического равновесия, – это температура окружающей среды. Увеличение температуры может способствовать ускорению процесса испарения жидкости и образованию пара, что может привести к снижению давления в системе. В свою очередь, понижение температуры может замедлить процесс испарения и привести к увеличению давления.
Еще одним важным фактором является давление в системе. Увеличение давления может способствовать увеличению температуры, что может привести к повышению интенсивности испарения и ускорению процесса установления равновесия. Наоборот, понижение давления может замедлить процесс испарения и затянуть установление равновесия.
Кроме того, влажность окружающей среды также может оказывать влияние на установление динамического равновесия. Увеличение влажности может способствовать ускорению испарения жидкости и образованию пара, что может ускорить процесс установления равновесия. Наоборот, снижение влажности может замедлить процесс испарения и затянуть установление равновесия.
Наконец, влияние внешних факторов на установление динамического равновесия также может зависеть от свойств используемой жидкости и ее парообразного состояния. Например, летучие жидкости могут более быстро испаряться и устанавливать равновесие, чем менее летучие жидкости.
В целом, различные внешние факторы, такие как температура, давление и влажность, могут оказывать значительное влияние на установление динамического равновесия пара и жидкости. Понимание этих влияний может помочь в разработке более эффективных систем управления процессом установления равновесия.
Роль температуры в установлении динамического равновесия пара и жидкости
Температура играет важную роль в установлении динамического равновесия между паром и жидкостью. При определенной температуре давление насыщенного пара становится равным давлению, оказываемому жидкостью, и происходит переход молекул с одной фазы на другую.
Тепловой поток между паром и жидкостью зависит от разницы температур, что влияет на скорость превращения пара в жидкость и наоборот. Если температура жидкости выше температуры насыщения, то происходит конденсация пара и образование жидкости. Если жидкость охлаждается ниже температуры насыщения пара, то происходит испарение жидкости и образование пара.
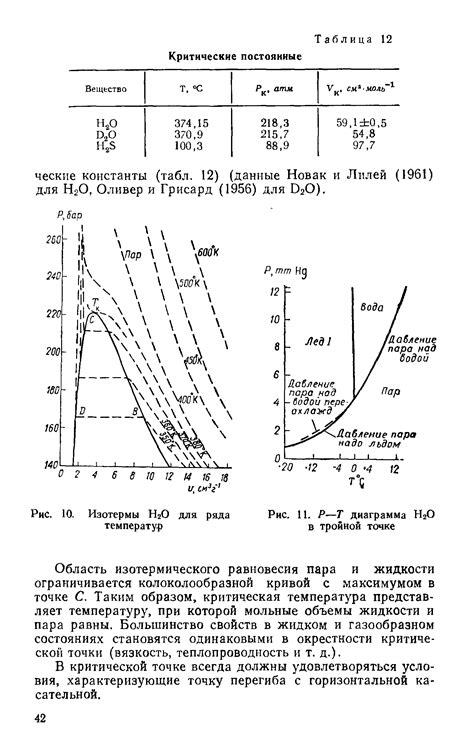
Точка кипения – это температура, при которой давление насыщенного пара становится равным атмосферному давлению. При этой температуре пар и жидкость сосуществуют в равновесии. Если жидкость нагревается выше точки кипения, то она превращается в пар. Если жидкость охлаждается ниже точки кипения, то происходит конденсация пара.
Таким образом, температура играет важную роль в балансировании между паром и жидкостью. Она определяет, в какой фазе будет находиться вещество и какой будет происходить переход между фазами.
Равновесие фаз при изменении температуры

Когда температура системы пара и жидкости изменяется, происходят изменения в равновесии фаз. Равновесие фаз в системе определяется соотношением между концентрацией пара и жидкости при определенной температуре и давлении.
При повышении температуры, концентрация пара в системе возрастает, так как молекулы жидкости получают энергию и переходят в газообразное состояние. В результате этого, давление пара растет.
Наоборот, при снижении температуры, концентрация пара уменьшается, и молекулы газа начинают конденсироваться обратно в жидкость. Это приводит к уменьшению давления пара.
Точка, при которой пар и жидкость находятся в равновесии при определенной температуре называется точкой кипения. При повышении температуры выше точки кипения, жидкость полностью переходит в пар, а при снижении температуры ниже точки кипения, пар полностью конденсируется обратно в жидкость.
Равновесие фаз при изменении температуры может быть представлено в виде таблицы, где указывается температура, давление и состояние вещества (пар или жидкость). Это позволяет наглядно представить, как меняется концентрация пара при изменении температуры.
| Температура | Давление | Состояние |
|---|---|---|
| Выше точки кипения | Высокое | Пар |
| Точка кипения | Константа | Равновесие пара и жидкости |
| Ниже точки кипения | Низкое | Жидкость |
Таким образом, равновесие фаз пара и жидкости при изменении температуры зависит от теплового движения молекул и их энергии. Изменения в равновесии фаз связаны с переходом молекул между газообразным и жидкостным состояниями при изменении температуры в системе.
Динамическое равновесие и химическая реакция

Динамическое равновесие пара и жидкости не всегда ограничивается только физическими процессами, такими как испарение и конденсация. Есть случаи, когда важную роль играют химические реакции, происходящие в системе.
Химические реакции могут возникать в результате взаимодействия пара и жидкости. Например, при повышении температуры и давления, молекулы жидкости могут легко перейти в паровую фазу, поскольку это их энергетически более выгодное состояние. В то же время, в паровой фазе могут происходить обратные реакции, когда паровые молекулы реагируют между собой и образуют молекулы жидкости.
Эти химические реакции важны при установлении динамического равновесия между паром и жидкостью. В этом случае концентрация паровых молекул и молекул жидкости остается примерно постоянной, и процессы испарения и конденсации компенсируют друг друга. Такое равновесие достигается благодаря химическим реакциям, которые происходят одновременно с физическими процессами.
Конкретные химические реакции, которые протекают при динамическом равновесии пара и жидкости, зависят от химического состава вещества. Например, при испарении воды молекулы H2O распадаются на молекулы водорода и кислорода. Эти молекулы затем могут реагировать друг с другом и образовывать обратные реакции, образуя вновь воду.
Изучение динамического равновесия пара и жидкости с учетом химических реакций имеет большое значение для различных отраслей науки и техники. Например, это важно в химической промышленности при разработке и оптимизации процессов обработки веществ, таких как синтез химических соединений или дистилляция смесей.
Таким образом, динамическое равновесие пара и жидкости может быть достигнуто не только физическими процессами, но и химическими реакциями, которые происходят в системе. Изучение этих химических реакций позволяет более полно понять и контролировать процессы испарения и конденсации, а также разрабатывать новые технологии и методы обработки веществ.
Примеры установления динамического равновесия пара и жидкости в различных системах

1. Теплообменникы
В теплообменниках происходит передача тепла между паром и жидкостью с целью обогрева или охлаждения жидкости. Пар и жидкость обмениваются теплом до тех пор, пока не установится равновесие температур. Динамическое равновесие в теплообменниках обеспечивает эффективный перенос тепла.
2. Морские и речные системы
В морских и речных системах пар и жидкость взаимодействуют в процессе испарения и конденсации. Вода испаряется, образуя пар, который впоследствии конденсируется и становится жидкостью. Этот процесс непрерывно повторяется, устанавливая динамическое равновесие между паром и жидкостью.
3. Автомобильные системы охлаждения
В системах охлаждения автомобиля пар и жидкость используются для поддержания оптимальной температуры двигателя. Жидкость перекачивается через двигатель, поглощает тепло и преобразуется в пар. Пар затем конденсируется в радиаторе, отводя тепло от соприкасающихся поверхностей. Процесс конденсации и испарения обеспечивает динамическое равновесие.
Таким образом, установление динамического равновесия пара и жидкости играет важную роль в различных системах, где происходит обмен массой и теплом. Понимание этих примеров поможет более глубоко изучить физические процессы, происходящие в паро-жидкостной системе.



