Хлор является одним из наиболее распространенных элементов в Периодической системе химических элементов. Его атомный номер - 17, что делает его идеальным кандидатом для множества химических реакций. Одним из интересных особенностей хлора является его способность иметь различные степени окисления, включая +1. В этой степени окисления хлор имеет необычные свойства и обнаруживает непредсказуемое поведение, которое заставляет ученых задуматься.
Степень окисления хлора определяет количество электронов, которые он принимает или отдает во время химической реакции. В обычных условиях хлор имеет степень окисления -1, что означает, что он получает один электрон. Однако, в определенных условиях, хлор может иметь степень окисления +1, что означает, что он теряет один электрон.
Когда хлор имеет степень окисления +1, его поведение становится отличным от привычного. Например, он может образовывать необычные соединения, которые обычно не наблюдаются при степени окисления -1. Кроме того, хлор +1 может быть более реакционноспособным и вступать в химические реакции, которые могут быть невозможны для хлора -1. Такое поведение хлора с необычной степенью окисления вызывает интерес исследователей и может иметь практическое применение в различных областях химии.
Хлор – важный элемент

В химии хлор обозначается символом Cl и имеет атомный номер 17. Он относится к галогенам и обладает отличительным запахом.
Одним из важных свойств хлора является его способность образовывать соли с другими элементами, такие как натрий и калий. Именно поэтому хлор используется в производстве многих химических соединений и материалов.
Однако хлор также известен и как ядовитое вещество. Когда его степень окисления равна 1, хлор обладает высокой реактивностью и может быть опасным для здоровья человека.
Хлор широко применяется в промышленности, в том числе в производстве пластмасс, текстиля, дезинфицирующих средств и многого другого. Он также используется в обработке питьевой воды и бассейнов для уничтожения бактерий и вирусов.
Таким образом, хлор играет важную роль в нашей жизни, обеспечивая безопасность и комфорт во многих отраслях и сферах быта.
Окисление и степень окисления
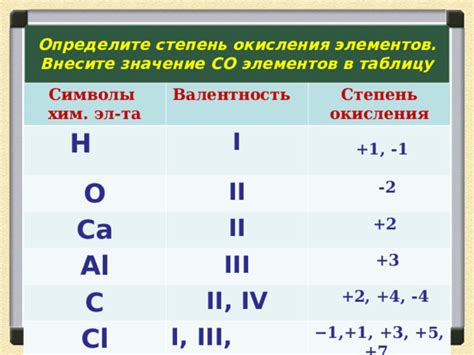
Степень окисления - это числовое значение, обозначающее количество электронов, переданных или принятых атомом или ионом во время окисления или восстановления. Степень окисления позволяет определить активность вещества и его реакционную способность.
Хлор - химический элемент с атомным номером 17. В стандартных условиях он представлен в виде газа с зловонным запахом и активно участвует в реакциях окисления и восстановления. Хлор может иметь разные степени окисления, одной из которых является степень окисления +1.
Степень окисления +1 хлора указывает на то, что в данной реакции хлор получает один электрон, окисляясь. Часто такую степень окисления имеет хлор в соединениях с металлами или водородом.
Знание степеней окисления различных элементов и их способности к окислению и восстановлению является важным для понимания химических реакций и прогнозирования их направления. Степень окисления хлора +1 позволяет предсказать его реакционную активность и возможность участия в различных химических реакциях.
Степень окисления хлора

Одной из наиболее распространенных степеней окисления хлора является +1. В этом случае хлор получает один электрон при реакции. Соединения с хлором в этой степени окисления часто используются в различных областях, таких как производство пластиков, фармацевтика и сельское хозяйство.
Соединения хлора с +1 степенью окисления можно легко опознать по их химическим формулам, которые содержат кислород и хлор. Например, хлорид гипохлорита (ClOCl) является одним из наиболее известных соединений хлора с +1 степенью окисления.
Степень окисления хлора может также быть и отрицательной. Например, волны хлора (Cl-) имеют -1 степень окисления, так как хлор отдает один электрон. Волны хлора находят широкое применение в химической промышленности как окислительные агенты.
Таким образом, степень окисления хлора может варьироваться от -1 до +7, в зависимости от конкретного соединения и условий реакции. Знание степеней окисления хлора помогает понять его химические свойства и применение в разных областях науки и промышленности.
Особенности степени окисления 1

- Хлор с данной степенью окисления наиболее распространен в хлористых и кислых газах, водных растворах и солях.
- В данной степени окисления хлор обычно образует однозарядные ионы, которые имеют положительный заряд.
- Эти ионы существуют в химических соединениях, таких как хлориды и гипохлориты.
- Хлор с окислением 1 может переходить в другие степени окисления в зависимости от условий реакции.
- Степень окисления 1 может быть использована для идентификации и расчета количества хлора в различных средах.
Таким образом, степень окисления 1 является важным аспектом в химии хлора и имеет свои уникальные особенности, которые определяют его химические свойства и реактивность.
Важные реакции с хлором

Если хлор имеет степень окисления +1, то он может вступать в реакцию со многими другими веществами. Некоторые важные реакции с хлором, при которых он взаимодействует с различными соединениями, включают:
- Реакция хлора с гидридами металлов. В результаты этой реакции образуются галогениды металлов и газ водород.
- Реакция хлора с гидридами не металлов. При взаимодействии хлора с гидридами не металлов, например с гидридом бора, образуются бороводород и галогениды.
- Реакция хлора с водородом. Хлор вступает в реакцию с водородом, образуя соляную кислоту.
- Реакция хлора с оксидами металлов. При реакции хлора с оксидами многих металлов образуется соль этого металла и хлорид.
- Реакция хлора с оксидами не металлов. При взаимодействии хлора с оксидами не металлов возникает образование галогенокислоты и соли кислоты.
Это только некоторые из важных реакций с хлором, которые используются в различных областях. Хлор имеет широкий спектр применений, благодаря своим уникальным свойствам и возможности вступать в реакцию с другими веществами.
Использование хлора с окислением 1

Одно из основных применений хлора с окислением 1 - это его использование в качестве дезинфицирующего средства. Хлор с окислением 1 эффективен против множества микроорганизмов, включая бактерии, вирусы и грибки. Поэтому его часто применяют для очистки воды и бассейнов. Хлор с окислением 1 позволяет удалить загрязнения и сохранить воду чистой и безопасной для плавания и питья.
Еще одна важная область применения хлора с окислением 1 - это использование его в процессе производства органических соединений. Хлор с окислением 1 может быть использован для получения различных хлорорганических соединений, которые являются важными компонентами в производстве пластиков, резиновых изделий, лекарств и других продуктов.
Хлор с окислением 1 также может быть использован в процессе химического синтеза. Благодаря своей активности, он может быть использован в качестве окислителя для окисления органических соединений и проведения различных реакций. Это позволяет получать разнообразные продукты, которые могут быть использованы в различных отраслях промышленности.
Значение хлора с окислением 1

Хлор с окислением 1 широко используется в различных химических процессах, таких как обеззараживание воды и производство хлорида натрия, которые служат основой для многих продуктов, используемых в сельском хозяйстве, медицине и бытовых целях.
Окисление хлора до степени 1 может происходить как при помощи электролиза, так и при реакции хлорида с веществами, которые имеют большую аффинность к электронам. В результате таких реакций хлор может быть обратно превращен в его основное окислительное состояние, со степенью окисления 0.
Значение хлора с окислением 1 необходимо учитывать при исследовании и применении этого элемента в различных областях науки и техники. Понимание его реакционной активности помогает нам лучше понять и использовать свойства и возможности этого важного химического соединения.