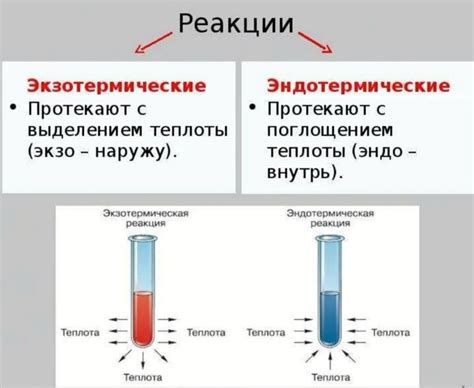
Реакции в химии могут быть различными по типу и характеру. В зависимости от того, как проходит процесс образования или разрушения химических связей, реакции могут быть классифицированы как экзотермические или эндотермические.
Экзотермические реакции характеризуются выделением тепла или энергии и сопровождаются повышением температуры окружающей среды. Во время экзотермической реакции энергетический уровень системы снижается, что говорит о выделении энергии. Примером экзотермической реакции может служить горение, при котором выделяется тепло и свет. Важно отметить, что экзотермические реакции происходят с выделением энергии, что отличает их от эндотермических.
В отличие от экзотермических, эндотермические реакции характеризуются поглощением тепла или энергии. Во время эндотермической реакции энергетический уровень системы повышается, т.е. происходит поглощение энергии. Часто эндотермические реакции требуют добавления энергии для инициирования или поддержания процесса. В ряде случаев, поглощение энергии может происходить за счет тепла окружающей среды или с использованием электроэнергии. Одним из примеров эндотермической реакции является процесс фотосинтеза, когда растения поглощают энергию света с помощью хлорофилла для получения необходимых питательных веществ.
Когда происходят экзотермические реакции
Экзотермические реакции происходят, когда энергия выделяется в процессе химической реакции. В результате таких реакций обычно выделяется тепло.
Экзотермические реакции могут происходить при различных условиях. Например, при сжигании горючих веществ, таких как дрова или бензин, происходят экзотермические реакции. Также при окислении металлов реакция может быть экзотермической.
Другим примером экзотермической реакции является сливание ядер в реакциях ядерного синтеза. В этом случае выделяется огромное количество энергии в виде тепла и света.
Экзотермические реакции могут иметь различные применения. Например, они используются в процессах сжигания топлива для получения энергии. Также экзотермические реакции могут использоваться в химической промышленности для получения различных продуктов.
Важно отметить, что экзотермические реакции могут быть опасными, если не контролировать выделение энергии. Поэтому при проведении таких реакций необходимо принимать меры предосторожности и следовать инструкциям.
Примеры экзотермических реакций
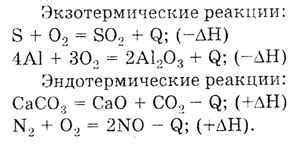
- Горение бумаги: при сжигании бумаги происходит реакция соединения бумаги и кислорода из воздуха, при которой выделяется тепло и свет. Также образуется углекислый газ.
- Взрыв динамита: взрыв динамита происходит из-за экзотермической реакции, которая происходит между нитроглицерином и окислителем. В результате реакции выделяется большое количество тепла и газов, что приводит к разрушительному эффекту взрыва.
- Реакция между ацетиленом и кислородом: при смешивании ацетилена (С₂H₂) с кислородом и последующем их возгорании происходит экзотермическая реакция, при которой выделяются тепло и свет. Особенностью этой реакции является образование яркой пламени и повышенной температуры.
- Сахар и кислород: при сжигании сахара (сахарозы) с кислородом, например при поджигании карточки с сахаром, происходит экзотермическая реакция, сопровождающаяся выделением света и тепла. В результате образуются углекислый газ и вода.
Это только несколько примеров экзотермических реакций, которые происходят в химических процессах. Химические реакции очень разнообразны и могут происходить с выделением или поглощением тепла.
Выделение энергии при экзотермических реакциях

Экзотермические реакции, как следует из их названия, происходят с выделением энергии. Во время таких реакций энергия освобождается из системы, что приводит к повышению температуры окружающей среды.
Примером экзотермической реакции является горение. При горении органических веществ, таких как древесина или уголь, выделяется большое количество энергии в виде тепла и света. Это объясняет, почему горящие предметы обычно нагреваются.
Другой пример экзотермической реакции можно найти в химии. Реакции окисления, такие как реакция сгорания металлов, также сопровождаются выделением энергии. Во время таких реакций молекулы металла реагируют с кислородом воздуха, освобождая тепло.
Следует отметить, что не все экзотермические реакции сопровождаются видимым выделением энергии. В некоторых случаях, освобождение энергии может быть столь малым, что его сложно заметить без специальных приборов.
Изучение экзотермических реакций имеет широкое применение в различных областях науки и техники. Они используются в процессах горения, теплотехнике, электроэнергетике и многих других отраслях. Понимание этих реакций позволяет улучшить процессы производства и эффективность их использования.
Экзотермические реакции происходят с выделением энергии из системы. Они могут быть обнаружены по повышению температуры окружающей среды и выделению тепла. Изучение этих реакций имеет важное значение для различных научных и технических областей.
Когда происходят эндотермические реакции

Эндотермические реакции происходят, когда система поглощает тепло из окружающей среды, что приводит к понижению ее температуры. В ходе этих реакций энергия поглощается системой, что обычно сопровождается охлаждением.
Эндотермические реакции характеризуются положительным значением теплоты реакции. Такие реакции требуют энергии для протекания и могут добиваться при определенных условиях.
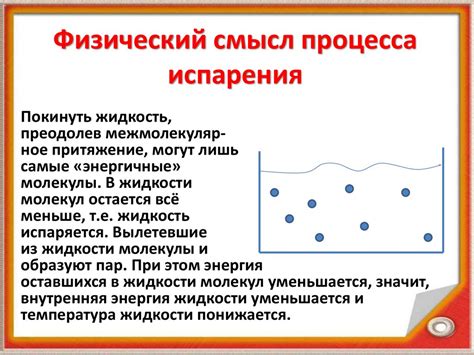
Примером эндотермической реакции является процесс испарения жидкости. Во время испарения жидкость поглощает тепло из окружающей среды, что приводит к ее охлаждению. При этом, молекулы получают достаточно энергии для преодоления сил притяжения друг к другу и переходят в газообразное состояние.
Другим примером эндотермической реакции является разложение карбоната аммония при нагревании. При нагревании твердый карбонат аммония распадается на два газа - углекислый газ и аммиак. Для этой реакции требуется энергия в виде тепла для протекания, поэтому она считается эндотермической.
| Примеры эндотермических реакций: |
|---|
| Испарение жидкостей |
| Разложение карбоната аммония |
| Восстановление медного оксида твердым гидрогеном |
| Эндотермическое разложение воды электрическим током |
Примеры эндотермических реакций

| Реакция | Уравнение |
|---|---|
| Распад аммиака | NH3 → 1.5H2 + 3/2N2 |
| Электролиз воды | 2H2O → 2H2 + O2 |
| Разложение карбоната кальция | CaCO3 → CaO + CO2 |
| Разложение аммонийной соли | NH4Cl → NH3 + HCl |
Эти реакции требуют поглощения тепла, чтобы происходило разрушение и формирование новых химических связей. Благодаря этому происходит понижение температуры в окружающей среде, что может быть использовано в различных процессах и технологиях.
Поглощение энергии при эндотермических реакциях
Основная причина поглощения энергии при эндотермических реакциях заключается в преобразовании химических связей. В молекулах реагентов частично разрываются сильные связи, требующие большого количества энергии, и образуются более слабые связи. В результате этих процессов поглощается тепло.
Примером эндотермической реакции может служить процесс плавления льда. Для того чтобы лед стал жидкой водой, необходимо поглотить тепло. При повышении температуры льда молекулы начинают двигаться более интенсивно и отдельные молекулы потеряют свои пространственные ориентации. Это ведет к разрыву водородных связей между молекулами льда, что требует поглощения энергии.
Еще одним примером эндотермической реакции является приготовление холодного сюрприза. Для этого необходимо смешать различные ингредиенты, которые взаимодействуют и поглощают тепло из окружающей среды, приводя к охлаждению системы и образованию холодного сюрприза.
Эндотермические реакции имеют широкое применение в различных областях науки и техники. Они используются в химическом синтезе, процессах охлаждения, производстве льда и других технологических процессах, требующих поглощения энергии.



