</p>
Щелочи и основания являются важными классами химических соединений, которые имеют сильно щелочную реакцию и обладают способностью взаимодействовать с кислотами. Они играют важную роль в химии и имеют множество применений в различных отраслях науки и промышленности.
Определить, является ли вещество щелочью или основанием, можно с помощью нескольких простых способов. Во-первых, можно проверить pH-значение вещества с помощью специального индикатора или прибора. Если pH-значение больше 7, то это свидетельствует о том, что вещество является щелочью или основанием.
Во-вторых, можно обратить внимание на его химический состав. Щелочи обычно содержат группу гидроксила (-OH), в то время как основания могут содержать аминогруппу (-NH2) или другую группу, способную взаимодействовать с кислотами.
Что такое щелочь и основание?
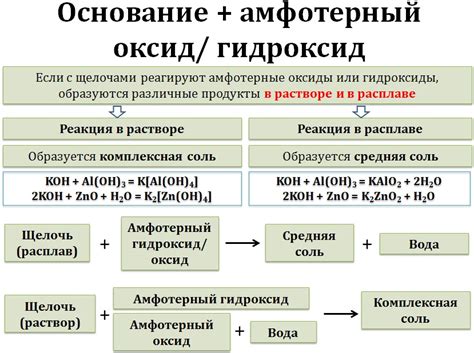
Щелочи являются особым видом оснований, которые образуются в результате реакции металлов с водой или кислородом. Они имеют ряд характеристических свойств, включая щелочную реакцию (повышенную щелочность) и способность нейтрализовать кислоты.
Основания - это широкий класс химических соединений, которые, в отличие от кислот, имеют способность принимать протоны (H+) от веществ с кислотностью. Они образуют соль и воду в результате реакции с кислотами. Основания, в зависимости от своей силы, могут быть слабыми или сильными.
Определение щелочи и основания

Основные свойства щелочей и оснований:
| Свойство | Описание |
|---|---|
| Щелочность | Щелочи обладают выраженной способностью изменять показатель pH раствора в сторону повышения (более 7). |
| Восстановительные свойства | Щелочи способны восстанавливать окислители, при этом сами окисляются. |
| Образование солей | Щелочи реагируют с кислотами, образуя соли и воду. |
| Электролитические свойства | Щелочи и основания в растворе разделяются на ионы, что делает раствор электролитическим. |
Определение щелочей и оснований играет важную роль в химии и позволяет понять их реактивные способности и возможности в применении.
Как отличить щелочь от основания:
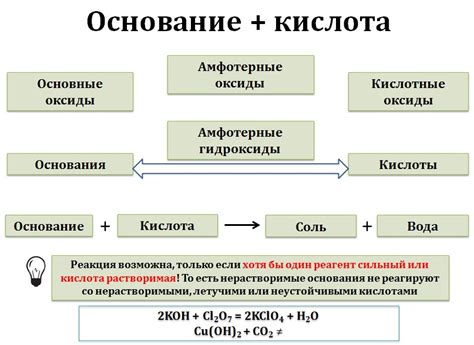
Ниже приведены несколько признаков, которые помогут вам отличить щелочь от других оснований:
- Формула вещества: Щелочи обычно имеют формулу MOH, где M – металл. Например, NaOH (гидроксид натрия), KOH (гидроксид калия).
- Реакция с кислотами: Щелочи образуют соли и воду при реакции с кислотами. Например, NaOH + HCl = NaCl + H2O.
- Щелочная среда: Щелочи имеют щелочную среду (pH более 7). Например, раствор NaOH имеет pH около 14.
- Способность растворения в воде: Щелочи обычно хорошо растворимы в воде.
- Химические свойства: Щелочи обладают способностью нейтрализовать кислоты и отдавать гидроксидные ионы в растворе.
Узнав эти признаки, вы сможете определить, является ли вещество щелочью или основанием и использовать эту информацию для решения химических задач и проведения экспериментов.
Физические свойства щелочей

Первое основное физическое свойство щелочей - их растворимость в воде. Щелочи образуют гигроскопичные растворы, которые способны впитывать влагу из окружающей атмосферы. Это свойство обусловлено присутствием гидроксидных ионов (OH-) в растворе.
Второе физическое свойство щелочей - их температурная устойчивость. Щелочные соединения обладают высокими температурами плавления и кипения, что делает их незаменимыми в некоторых промышленных процессах, таких как плавление металлов или производство стекла.
Третье физическое свойство щелочей - их вязкость. Щелочные растворы могут быть густыми и липкими, что делает их легко использовать в качестве смазок или клеев в различных отраслях промышленности.
Четвертое физическое свойство щелочей - их электропроводность. Щелочные растворы обладают высокой электропроводимостью, что делает их полезными для использования в различных электротехнических приложениях, таких как аккумуляторы или электролиз.
Таким образом, знание физических свойств щелочей помогает понять их роль и применение в различных отраслях науки и промышленности.
Физические свойства оснований

Основания, или щелочи, имеют ряд характерных физических свойств, которые можно использовать для их определения.
1. Растворимость в воде
Основания растворяются в воде, образуя растворы щелочной реакции. При этом они образуют гидроксиды металлов, которые хорошо растворимы в воде.
Пример: гидроксид натрия (NaOH) хорошо растворяется в воде, образуя щелочной раствор.
2. Поведение с индикаторами
Основания проявляют щелочную реакцию в присутствии индикаторов, изменив их цвет. Они обладают способностью изменять кислотно-щелочной показатель (рН) раствора до щелочной стороны шкалы.
Пример: метилоранж (CH3COONa) при взаимодействии с основанием становится красным.
3. Образование щелочей при реакции
При взаимодействии с кислотами основания образуют соли и воду. При этом основания обладают способностью нейтрализовать кислоты.
Пример: гидроксид натрия реагирует с соляной кислотой, образуя хлорид натрия и воду.
4. Проводимость растворов
Основания, как и кислоты, обладают способностью проводить электрический ток в растворе. При диссоциации в воде основания образуют ионы гидроксида (OH-), которые способны проводить электрический ток.



