Ионная связь – один из видов химической связи между атомами или ионами. Она возникает при образовании пары ионов с противоположными зарядами и является результатом перехода одного или нескольких электронов от одного атома к другому.
Как происходит образование ионной связи? Представьте, что у нас есть два атома – натрия и хлора. Натрий имеет один свободный электрон во внешней электронной оболочке, а хлор – семь электронов во внешней оболочке. Натрий хочет избавиться от своего свободного электрона, а хлор нуждается в еще одном электроне для заполнения своей внешней оболочки. Ионная связь строится на этой взаимной потребности.
При взаимодействии натрия и хлора происходит передача электрона от натрия к хлору. Таким образом, натрий становится положительно заряженным ионом Na+, а хлор – отрицательно заряженным ионом Cl-. Образуются ионы, обладающие противоположными зарядами, и происходит образование ионной связи между ними.
Понятие ионной связи

Основными участниками ионной связи являются ионы, которые состоят из положительно и отрицательно заряженных частиц. Положительно заряженные ионы называются катионами, а отрицательно заряженные - анионами.
Ионные связи обладают высокой прочностью и являются необходимыми для образования и стабилизации многих соединений. Например, ионная связь играет важную роль в образовании солей и многих минералов.
Ионная связь имеет свои особенности и правила образования. Обычно ионная связь возникает между металлами и неметаллами, когда металл отдает свои электроны неметаллу, формируя положительно заряженный катион и отрицательно заряженный анион. Таким образом, возникает электростатическое притяжение между заряженными ионами, и составленное из них вещество обладает стабильной структурой.
| Катион | Анион |
|---|---|
| Na+ | Cl- |
| K+ | O2- |
| Mg2+ | F- |
В ионной связи, энергия связи зависит от расстояния между ионами и их зарядов. Чем больше заряд ионов и чем меньше расстояние между ними, тем сильнее будет ионная связь. В этом свойстве ионная связь отличается от ковалентной связи, где энергия связи зависит от наличия общих электронных пар между атомами.
Ионная связь играет важную роль в химии и имеет много применений. Это обеспечивает устойчивость многих соединений, образует ионообменные и укрепляет силы веществ.
Свойства ионной связи
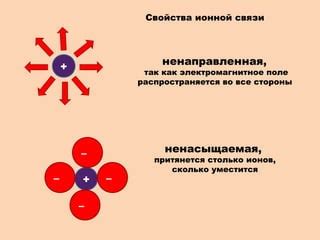
Свойства ионной связи включают:
1. Сильность связи: Ионная связь является одной из наиболее сильных химических связей. Это означает, что энергия, необходимая для разрыва ионной связи, обычно очень высока.
2. Решеточная энергия: Ионное соединение образует кристаллическую структуру, которая является результатом силы ионных взаимодействий. Решеточная энергия отражает суммарную энергию взаимодействия между ионами в кристаллической решетке.
3. Точка плавления: Ионные соединения обычно имеют высокие точки плавления. Это связано с жесткой кристаллической структурой, которая требует большого количества энергии для нарушения.
4. Проводимость: В твердом состоянии ионные соединения не проводят электричество. Однако, в расплаве или растворе, ионные соединения разрываются на положительные и отрицательные ионы и становятся электролитами. Они могут проводить электрический ток из-за движения заряженных частиц.
5. Растворимость: Ионные соединения обычно хорошо растворимы в воде. Вода обладает полярностью и способна разделять ионы, образующие ионное соединение, таким образом, создавая раствор.
6. Хрупкость: Ионные соединения обычно обладают хрупкостью, то есть они легко разрушаются при механическом воздействии. Это связано с жесткой и упорядоченной структурой ионной решетки.
В целом, ионная связь имеет множество важных свойств, которые определяют ее роль в химии и участвуют в различных физических и химических явлениях.
Применение ионной связи

Ионная связь играет важную роль во многих аспектах химии и материаловедения. Ниже приведены некоторые области применения ионной связи:
1. Кристаллические соединения: Ионная связь является основной формой связи в кристаллических соединениях, таких как соли. Эти соединения имеют определенную структуру, где положительные и отрицательные ионы располагаются в регулярном порядке, образуя кристаллическую решетку.
2. Соединения в растворе: Ионная связь также играет важную роль в растворах. Когда ионизированные вещества растворяются в воде, связь между ионами ослабевает, и они свободно перемещаются.
3. Электролиты: Ионные соединения, как правило, являются электролитами, то есть веществами, которые проводят электрический ток в растворе или расплаве.
4. Катализ: Ионы могут служить в качестве катализаторов, ускоряющих химические реакции. Например, ионы металлов могут участвовать в катализе важных промышленных процессов, таких как производство аммиака или перекиси водорода.
5. Стабильность соединений: Ионная связь обеспечивает стабильность соединений, так как ее энергия связи обычно высока. Это позволяет соединениям находиться в устойчивом состоянии и не легко распадаться под действием различных условий.
Это лишь несколько примеров применения ионной связи в химии и научных исследованиях. Ионная связь является фундаментальным концептом, позволяющим понять и объяснить множество химических явлений и свойств веществ.