Изучение физики в школе открывает перед нами удивительный мир невидимых частиц и явлений. Одним из фундаментальных понятий в физике является молекула. Молекула - это минимальная часть вещества, обладающая его химическими свойствами. Но как определить число молекул в веществе?
Для этого можно воспользоваться понятием молярной массы. Молярная масса - это масса одного моля вещества, выраженная в граммах. Она равна сумме атомных масс всех элементов, составляющих молекулу. Таким образом, зная массу вещества и его молярную массу, можно определить количество молекул.
Формула для расчета числа молекул в веществе следующая: число молекул = масса вещества / молярную массу. Используя эту формулу, можно определить количество молекул в любом веществе, будь то вода, воздух или любой другой химический соединение.
Как определить количество молекул в физике 10 класс

Для определения количества молекул в физике в 10 классе можно использовать формулу, известную как формула Авогадро.
1 моль вещества содержит 6,022 × 10^23 молекул. Это число называется числом Авогадро.
Чтобы найти количество молекул в заданном количестве вещества, необходимо выполнить следующие шаги:
- Определить количество вещества в граммах (массу).
- С помощью периодической таблицы найти молярную массу вещества.
- Разделить массу вещества на его молярную массу, чтобы получить количество молей.
- Умножить количество молей на числовое значение числа Авогадро (6,022 × 10^23), чтобы найти количество молекул.
Важно помнить, что полученное количество молекул будет приближенным, так как в реальном мире невозможно иметь абсолютное количество молекул.
Молекулы: основные понятия

Атом - это основная структурная единица вещества, состоящая из протонов, нейтронов и электронов. Он имеет положительный заряд протонов, отрицательный заряд электронов и нейтральный заряд нейтронов.
Молекулярная формула - это символическое представление состава молекулы, в котором указываются атомы, их количество и способ связи между ними. Например, воду обозначают молекулярной формулой H2O, что означает, что одна молекула воды состоит из двух атомов водорода и одного атома кислорода.
Молярная масса - это масса одной молекулы вещества, измеряемая в атомных единицах массы (a.e.м.). Для расчета молярной массы вещества складываются массы атомов, входящих в его молекулу, умноженные на их количество.
Число молекул вещества - это количество молекул, содержащихся в данном веществе. Его можно вычислить с помощью формулы числа молекул, используя мольную массу и массу данного вещества.
- Моль - это единица измерения количества вещества, равная количеству вещества, содержащемуся в системе, содержащей столько же элементарных единиц (атомов, молекул, ионов и т.д.), сколько атомов содержится в 0,012 кг углерода-12.
- Число Авогадро - это фундаментальная постоянная, равная числу атомов в 12 граммах углерода-12. Ее значение приближенно равно 6,022 × 10^23 атомов/моль.
С помощью этих понятий можно решать различные задачи в физике и химии, связанные с определением количества молекул вещества и другими химическими процессами.
Атомы: структура и связи
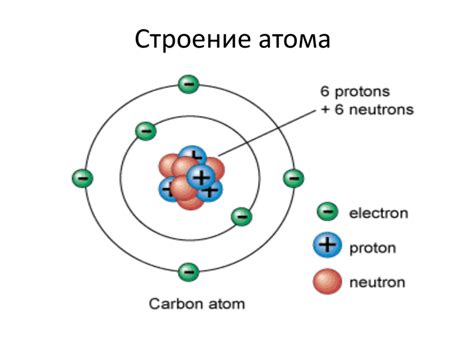
Атомы объединяются между собой на основе различных типов связей. Ионная связь образуется, когда один атом отдает электрон(ы), а другой атом получает их. В результате образуется положительно и отрицательно заряженные ионы, которые притягиваются друг к другу. Ковалентная связь возникает, когда два атома обмениваются электронами и образуют общую пару электронов между собой. В результате образуется молекула, которая является стабильной структурой.
Изучение структуры и связей атомов позволяет более глубоко понять химические реакции, физические свойства веществ и многое другое. В химии и физике основными единицами измерения атомов и молекул являются моль и молярная масса. Моль - это единица измерения количества вещества, а молярная масса - это масса одной моли вещества. Зная массу вещества, можно вычислить количество молекул или атомов в нем.
| Тип связи | Описание |
|---|---|
| Ионная связь | Связь, образуемая между атомами, когда один атом отдает электрон(ы), а другой атом получает их |
| Ковалентная связь | Связь, образуемая, когда два атома обмениваются электронами и образуют общую пару электронов между собой |
Химические формулы и их использование
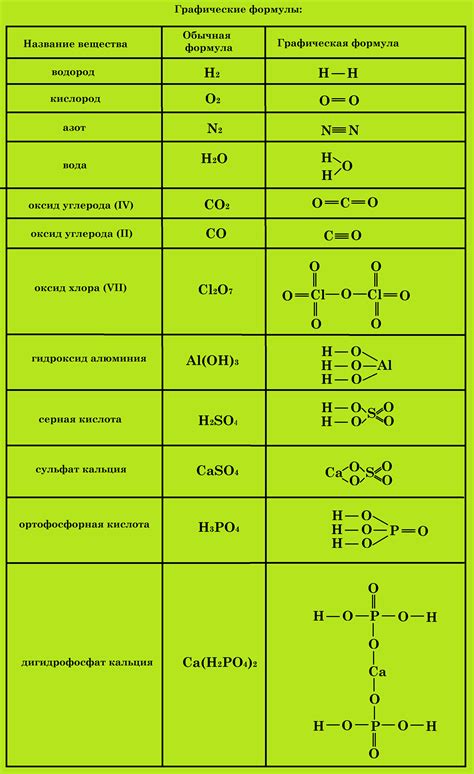
Химические формулы представляют собой символическое представление химических соединений. Они позволяют упрощенно описывать состав и структуру вещества, а также проводить различные расчеты и прогнозы.
Химические формулы состоят из символов элементов и числовых коэффициентов, которые указывают количество атомов каждого элемента в соединении.
Например, формула воды - H2O, где H обозначает атом водорода, а O - атом кислорода. Число 2 перед формулой H указывает на то, что в молекуле воды содержится два атома водорода.
Химические формулы могут быть простыми, например, формула хлора - Cl2, или сложными, как в случае железа(III) оксида - Fe2O3. В этом случае числовые индексы указывают на количество атомов каждого элемента в соединении.
Химические формулы являются важной основой для понимания и изучения реакций, свойств и состава веществ. Они также позволяют проводить различные расчеты, например, определение массы соединения и количество молекул вещества.
Использование правильных химических формул и их анализ являются необходимыми навыками для успешной работы в химических науках и индустрии.
Молярная масса и структура вещества

Структура вещества определяется типом и связями его частиц. Частицы могут быть атомами, молекулами или ионами. Атом - это минимальная единица вещества, которая сохраняет его химические свойства. Молекула - это группа атомов, связанных между собой. Ион - это заряженная частица, образованная либо потерей, либо приобретением электронов.
Молярная масса вещества рассчитывается по формуле:
- Для ионной соли: молярная масса = сумма масс ионов;
- Для молекулярного вещества: молярная масса = сумма масс атомов в молекуле;
- Для смеси веществ: молярная масса = сумма произведений масс каждого компонента с его молярной долей.
Молярная масса вещества выражается в граммах на моль. При необходимости перевести ее в другие единицы измерения, используют массовые единицы или единицы количества вещества.
Понимание молярной массы и структуры вещества помогает в изучении физики и химии. Эти знания позволяют проводить различные расчеты и анализировать свойства различных веществ, что необходимо для решения многих задач в науке и технике.
Моль: единица измерения количества вещества
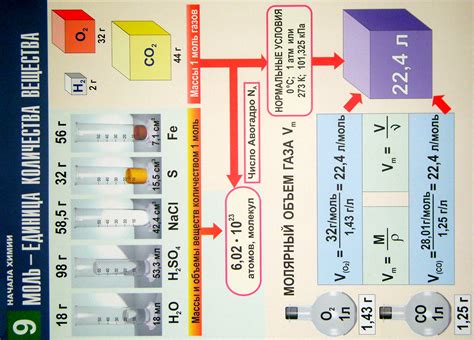
Моль позволяет определить, сколько частиц (атомов, молекул, ионов и т.д.) содержится в данном количестве вещества. Один моль соответствует количеству атомов, равному числу Авогадро, которое составляет примерно 6,022 × 10^23. Это число называется постоянной Авогадро.
Количество вещества можно рассчитать, зная массу вещества и его молярную массу. Молярная масса выражается в единицах г/моль и равна массе одного моля вещества. Она рассчитывается путем сложения атомных масс всех атомов, входящих в молекулу.
Количество молекул вещества определяется по формуле:
Количество молекул = количество вещества (в молях) × постоянная Авогадро
Использование моли позволяет сравнивать количества разных веществ и проводить точные расчеты в различных химических и физических процессах.
Использование формулы расчета числа молекул

Для расчета числа молекул в веществе можно использовать формулу, основанную на Авогадро-Лоссаноа числе. Это позволяет определить количество молекул вещества и оценить его массу. Формула выглядит следующим образом:
N = m/(M * NA)
Где:
- N - число молекул вещества;
- m - масса вещества в граммах;
- M - молярная масса вещества в г/моль;
- NA - Авогадро-Лоссано число, равное примерно 6,022 *10^23 молекул на моль.
Для использования формулы необходимо знать массу вещества и его молярную массу. Подставив эти значения в формулу и произведя расчет, можно получить количество молекул вещества. Это число поможет лучше понять масштабы молекулярных структур и осознать, насколько малы молекулы по сравнению с нашими повседневными представлениями о размерах.
Обратите внимание, что формула описывает число молекул, а не конкретное их расположение. Также она не учитывает всякие влияния на плотность вещества и состояние вещества. Расчеты по этой формуле могут использоваться в различных областях физики, химии и др.
Практические примеры расчета количества молекул

В физике, количество молекул вещества можно рассчитать с использованием формулы:
молекулы = (масса / молярная масса) * число Авогадро
где:
- молекулы - количество молекул вещества
- масса - масса вещества в граммах
- молярная масса - масса одной молекулы вещества в граммах
- число Авогадро - постоянная, равная приблизительно 6.022 * 10^23 молекул/моль
Давайте рассмотрим несколько практических примеров:
| Пример | Масса вещества (г) | Молярная масса (г/моль) | Результат (молекулы) |
|---|---|---|---|
| Пример 1 | 10 | 18 | 3.344 * 10^23 |
| Пример 2 | 25 | 32 | 1.327 * 10^24 |
| Пример 3 | 50 | 46 | 6.912 * 10^23 |
Таким образом, путем использования данной формулы и соответствующих значений массы вещества и молярной массы, можно определить количество молекул вещества в данном примере.