Кислоты - важные химические соединения, которые широко применяются в нашей повседневной жизни. Измерение массы кислоты в растворе является важным шагом в химическом анализе и может быть необходимым для определения концентрации кислоты или расчета необходимого количества для определенной реакции.
Определение массы кислоты в растворе может быть выполнено несколькими способами в зависимости от доступных средств и техники. Один из самых распространенных методов - титрование с использованием индикатора. В этом методе кислотный раствор титруется с раствором, известной концентрации щелочи до достижения точки эквивалентности, где количества кислоты и щелочи становятся эквивалентными.
Во время титрования необходимо внимательно следить за цветом индикатора, который меняется при достижении точки эквивалентности. После того, как точка эквивалентности достигнута, можно расчитать массу кислоты в растворе с использованием стехиометрических соотношений между кислотой и щелочью. Этот метод точен и позволяет определить массу кислоты с высокой точностью.
Методы определения массы кислоты в растворе

1. Титриметрический метод
Титриметрия – это метод определения концентрации раствора с помощью известного реагента. Для определения массы кислоты в растворе применяется титрование. Кислоту титруют раствором щелочи или раствором вещества, способного нейтрализовать кислоту. При этом определяется точное количество реагента, необходимого для полного нейтрализации кислоты. Известна концентрация и объем реагента, поэтому можно рассчитать массу кислоты в растворе.
2. Гравиметрический метод
Гравиметрия – это метод определения массы вещества с использованием взаимодействия реагента с исследуемым веществом. В гравиметрическом методе определения массы кислоты в растворе применяется отжигание. Раствор кислоты подвергается термической обработке, в результате чего происходит испарение растворителя и образование остатка – сухого вещества. Масса остатка соответствует массе кислоты в растворе.
3. Ионометрический метод
Ионометрия – это метод определения концентрации ионов определенного вещества в растворе с использованием электрических свойств. Ионометрический метод используется для определения массы кислоты в растворе с помощью измерения потенциала ион-электрода в растворе кислоты. По полученным данным рассчитывается концентрация и масса кислоты в растворе.
Выбор определенного метода зависит от химических свойств кислоты и возможностей лаборатории. Проведение точного определения массы кислоты в растворе требует соблюдения всех необходимых технических условий и применения точных реагентов и инструментов.
Титрование
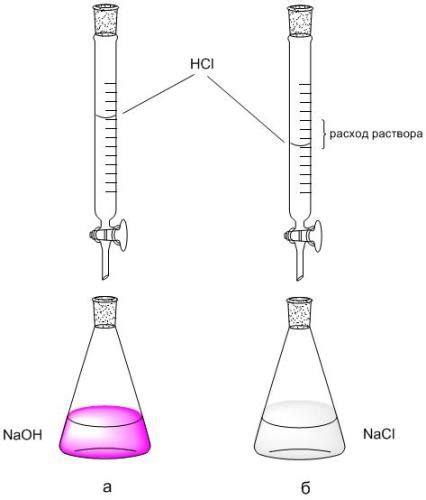
В процессе титрования измеряется объем раствора титранта, необходимого для полного нейтрализации раствора кислоты. По известному объему титранта и его концентрации можно рассчитать количество кислоты в растворе с помощью уравнения реакции и молярной массы кислоты.
Для проведения титрования необходимо:
- Точно измерить концентрацию титранта (раствора щелочи).
- Точно измерить объем титранта, необходимого для полного нейтрализации кислоты.
- Рассчитать массу кислоты в растворе по известным данным.
Титрование является достаточно точным и практически всегда дает результат, если правильно подобраны реагенты и правильно проведена экспериментальная процедура. Этот метод широко используется в химических исследованиях и аналитической химии.
| Пример таблицы для записи результатов титрования: | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
По полученным данным можно рассчитать среднее значение и погрешность определения массы кислоты в растворе. Также можно провести повторные титрования для повышения точности результатов.
Гравиметрический метод

Для определения массы кислоты в растворе с помощью гравиметрического метода требуется провести следующие этапы:
- Приготовить рабочий раствор кислоты нужной концентрации.
- Взвесить точно заданное количество раствора кислоты.
- Провести реакцию кислоты с реагентом, образующим нерастворимый осадок.
- Отфильтровать осадок и тщательно промыть его, чтобы удалить остатки реакционной смеси.
- Высушить осадок на воздухе или при низкой температуре.
- Взвесить полученный осадок.
- Рассчитать массу кислоты в растворе с помощью соотношения между массой осадка и массой кислоты.
Гравиметрический метод определения массы кислоты в растворе является одним из самых точных и надежных методов. Он часто применяется в аналитической химии и используется для определения массовой концентрации кислоты в различных образцах.
| Преимущества | Недостатки |
|---|---|
| Высокая точность и надежность результатов | Времязатратность выполнения всех этапов |
| Не требует дорогостоящего оборудования | Возможность нарушения сохранения массы при неправильном выполнении этапов |
| Может быть применен для образцов с низкой и высокой концентрацией кислоты |
Электронный метод

Для проведения этого метода необходимо использовать специальное устройство – электролизер, оснащенный мерной камерой и электродами. В мерную камеру наливают определенный объем раствора кислоты, который затем подвергается электролизу.
При электролизе кислота распадается на положительные и отрицательные ионы, которые начинают двигаться к противоположным электродам. Измеряя скорость их движения, можно определить электрическую проводимость раствора кислоты.
Чем выше концентрация кислоты, тем выше проводимость раствора. Измерив проводимость раствора и зная его объем, можно рассчитать массу кислоты по формуле, учитывающей плотность кислоты.
Электронный метод позволяет достичь точности определения до сотых долей грамма и широко применяется в химическом анализе. Однако для его проведения требуется специальное оборудование и определенные навыки в работе с ним.
Фотометрический метод
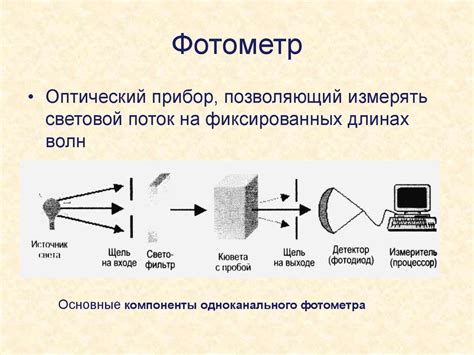
Принцип работы фотометрического метода заключается в том, что когда кислота реагирует с реагентом или образует комплекс с индикатором, происходит изменение прозрачности раствора. Это изменение прозрачности может быть измерено с помощью фотометра, который определяет оптическую плотность раствора.
Для определения массы кислоты в растворе с помощью фотометрического метода необходимо провести следующие шаги:
- Приготовить раствор кислоты с известной концентрацией.
- Добавить реагент или индикатор, который вызовет изменение прозрачности раствора.
- Измерить оптическую плотность раствора с помощью фотометра.
- Сравнить полученное значение оптической плотности с калибровочной кривой, зависящей от известных концентраций кислоты.
- Определить массу кислоты в растворе на основе данных калибровочной кривой.
Фотометрический метод является достаточно точным и удобным способом определения массы кислоты в растворе, но требует наличия специального оборудования - фотометра.
Измерение теплового эффекта

Измерение теплового эффекта реакции позволяет определить количество выделившейся или поглотившейся энергии во время химической реакции. Это важный параметр, который позволяет определить, насколько реакция эндотермическая или экзотермическая.
Один из способов измерения теплового эффекта - использование калориметра. Калориметр представляет собой устройство, которое позволяет измерить теплообмен между системой и окружающей средой.
Для измерения теплового эффекта можно провести следующие шаги:
- Подготовьте калориметр: заполните его измерительным чашечкой и установите термометр.
- Измерьте начальную температуру системы.
- Произведите реакцию и измерьте конечную температуру системы.
- Рассчитайте изменение температуры путем вычитания начальной температуры из конечной.
- Используя известную теплоемкость калориметра, определите количество поглощенной или выделившейся энергии с помощью уравнения:
тепло = масса вещества × изменение температуры × теплоемкость калориметра
Таким образом, путем измерения теплового эффекта реакции и зная массу вещества, можно определить количество выделившейся или поглотившейся энергии и, соответственно, массу кислоты в растворе.
Измерение теплового эффекта позволяет получить количественную информацию о реакции и использовать ее для различных химических расчетов и анализа.



