Химия – один из важнейших предметов, изучаемых в основной школе. Восьмиклассники знакомятся с основными понятиями и законами молекулярной науки. Важным аспектом изучения химии является умение работать с коэффициентами.
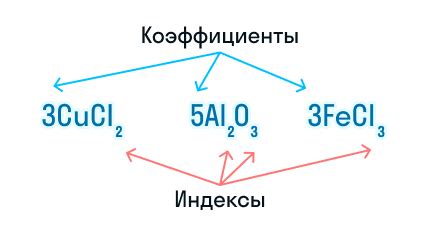
Коэффициенты – это числа, которые указывают, сколько молекул или атомов участвует в химической реакции. Они помогают сбалансировать уравнение, чтобы соблюсти закон сохранения массы. Правильное использование коэффициентов позволяет предсказать результаты реакции и определить её тип: синтез, анализ, движение вперёд или в обратном направлении.
Для определения коэффициентов в химии 8 класс необходимо уметь анализировать вещества, участвующие в реакции, и составлять уравнения. Балансировка уравнений – это процесс, позволяющий установить соотношение между реагентами и продуктами реакции. Коэффициенты в уравнении обозначают количество молекул, атомов или ионов каждого вещества.
Что такое коэффициенты в химии

Коэффициенты в химических уравнениях помогают балансировать реакции, то есть выравнивать количество атомов каждого элемента на обеих сторонах уравнения. Без коэффициентов уравнение будет небалансированным и не отражает точное соотношение между реагентами и продуктами.
Важно помнить, что коэффициенты в химии всегда записывают перед формулами реагентов и продуктов, а не между атомами или молекулами. Они показывают, сколько раз данная формула участвует в реакции.
Коэффициенты могут быть рациональными числами или целыми числами. Они могут быть положительными или отрицательными, но обычно используются только положительные значения.
Одной из основных задач химика является определение коэффициентов в химических уравнениях, чтобы соблюсти закон сохранения массы и энергии. Без правильных коэффициентов уравнение будет неверным и неправильно отражать процессы, происходящие в реакции.
| Обозначение | Описание |
|---|---|
| Уравнение реакции | Химическое уравнение, включающее реагенты и продукты уравнения |
| Коэффициент | Число перед формулой реагента или продукта в уравнении реакции |
| Балансировка | Процесс выравнивания количества атомов каждого элемента на обеих сторонах уравнения реакции |
| Закон сохранения массы | Принцип, согласно которому масса реагентов должна быть равна массе продуктов в химической реакции |
Зачем нужны коэффициенты в химии
Основная задача коэффициентов в химии состоит в сбалансировке химических уравнений. Балансировка позволяет сохранить массу и атомный состав веществ до и после химической реакции. Коэффициенты используются для согласования количества атомов каждого элемента с обеих сторон уравнения.
Коэффициенты также помогают определить соотношение между различными веществами, участвующими в реакции. Они позволяют нам учесть пропорции реагентов и продуктов химической реакции. Например, если у нас есть уравнение, где один молекула вещества А реагирует с двумя молекулами вещества В, то коэффициент вещества В будет равен 2. Это говорит нам о том, что вещество В участвует в реакции в два раза больше, чем вещество А.
Коэффициенты также важны при расчете количества вещества в химической реакции. Они позволяют нам узнать, сколько вещества будет получено или израсходовано при заданном количестве реагентов. Используя стехиометрические расчеты, можно определить, какое количество реагента необходимо для получения определенного количества продукта.
В итоге, коэффициенты в химии играют важную роль в понимании и описании химических реакций. Они помогают нам балансировать уравнения, определить соотношения между реагентами и продуктами, а также рассчитать количества вещества, участвующих в реакции. Без коэффициентов химия была бы сложнее и менее точной наукой.
Правила определения коэффициентов

Основные правила определения коэффициентов включают:
- Коэффициенты всегда пишут после формул реагентов или продуктов.
- Коэффициенты указываются перед формулами вещества, которые они умножают.
- Коэффициенты должны быть наименьшими целыми числами, чтобы показать соотношение между веществами.
- Коэффициенты влияют на количество атомов каждого элемента в химическом уравнении.
Правильное определение коэффициентов позволяет соблюдать закон сохранения массы и заряда в химических реакциях. Также, сбалансированные уравнения помогают определить количество вещества, которое реагирует или образуется в результате химической реакции.
Важно помнить, что коэффициенты могут быть изменены, но только при условии, что все формулы веществ и их соотношения останутся прежними. При изменении коэффициентов вещество будет присутствовать в реакции в другом количестве.
Правильное использование коэффициентов в химии помогает понять наличие и количество веществ в реакции, а также предсказать результаты химических превращений.
Как узнать коэффициенты в уравнении реакции

В химии коэффициенты используются для сбалансирования уравнений реакций. Сбалансированное уравнение реакции показывает правильное соотношение реагирующих веществ и продуктов.
Чтобы узнать коэффициенты в уравнении реакции, нужно следовать определенным шагам:
- Определить все реагирующие вещества и продукты реакции.
- Записать уравнение реакции, указав все реагенты и продукты.
- Восстановить окислительно-восстановительные числа элементов во всех веществах.
- Использовать окислительно-восстановительные числа, чтобы определить необходимые коэффициенты в уравнении.
- Сбалансировать уравнение, уравняв количество атомов каждого элемента на обоих сторонах.
Подробное объяснение каждого шага с примерами можно найти в специальной литературе по химии или в Интернете. Коэффициенты в уравнении реакции важны для понимания химических процессов и выполнения расчетов, связанных с количеством веществ, участвующих в реакции.
Необходимо помнить, что коэффициенты в уравнении реакции обычно являются целыми числами и могут быть установлены только опытным путем. Правильное сбалансированное уравнение реакции позволяет изображать превращение веществ и проводить анализ химических превращений.
Коэффициенты в уравнениях химических реакций
Коэффициенты показывают, сколько молекул или атомов данного вещества участвует в реакции. Они позволяют сбалансировать уравнение химической реакции, то есть сделать количество атомов каждого элемента одинаковым на обеих сторонах уравнения.
Сбалансированное уравнение химической реакции позволяет определить соотношение между количеством реагентов и продуктов, а также провести расчеты, связанные с массой и объемом веществ.
Чтобы узнать коэффициенты в уравнении химической реакции, необходимо использовать закономерности химических превращений и знания об атомном составе веществ. Некоторые уравнения могут быть сбалансированы интуитивно, но в большинстве случаев требуется использование математических методов, например, метода подстановки или метода окислительно-восстановительных реакций.
Коэффициенты в химических уравнениях должны быть наименьшими целыми числами и могут обозначать количество молекул, атомов или ионов. Они позволяют сохранить массу и заряд веществ на обеих сторонах уравнения, а также учтены в балансировочных коэффициентах.
Примеры использования коэффициентов
Коэффициенты в химии играют важную роль при написании химических уравнений. Они указывают на количество молекул или атомов каждого вещества, участвующих в реакции. Рассмотрим несколько примеров использования коэффициентов:
- Для сбалансирования уравнения реакции:
- CH4 + 2O2 → CO2 + 2H2O
В данном случае коэффициенты перед молекулами CH4 и O2 указывают на то, что для полного сгорания одной молекулы метана требуется две молекулы кислорода. Также, благодаря коэффициентам, видно, что в результате реакции образуется одна молекула CO2 и две молекулы воды.
- 2H2O → 2H2 + O2
Здесь коэффициенты показывают, что для разложения двух молекул воды необходимо образование двух молекул водорода и одной молекулы кислорода. Также коэффициенты позволяют определить массу продуктов реакции на основе массы исходного вещества.
- 2NaCl + CuSO4 → Na2SO4 + CuCl2
В данной реакции коэффициенты перед веществами показывают, какое количество их соотносится друг с другом. Так, две молекулы NaCl реагируют с одной молекулой CuSO4 и образуют одну молекулу Na2SO4 и две молекулы CuCl2.
Таким образом, использование коэффициентов позволяет правильно и точно записывать и пропорционально сбалансировывать химические уравнения, а также определять массу вещества, отношения между ними и другие химические характеристики реакции.
Применение коэффициентов в химии

1. Балансировка химических уравнений:
Один из основных способов использования коэффициентов в химии - это балансировка химических уравнений. Коэффициенты помогают указать правильное соотношение между реагентами и продуктами и обеспечивают сохранение массы вещества во время реакции.
2. Расчеты количества вещества:
Коэффициенты также позволяют выполнять различные расчеты в химии. Например, зная количество одного вещества и его коэффициент в химическом уравнении, можно рассчитать количество другого вещества, участвующего в реакции.
3. Определение стехиометрических соотношений:
Коэффициенты в химических уравнениях также позволяют определить стехиометрические соотношения между веществами в реакции. Они указывают, в каком соотношении происходит соединение и разделение атомов вещества.
Важно помнить, что коэффициенты в химии необходимо указывать с учетом правил балансировки уравнений, чтобы обеспечить достоверные результаты и соблюдение закона сохранения массы.



