Произведение растворимости через ЭДС - это важный параметр, который характеризует степень распада вещества в растворе. Изучение этого показателя позволяет определить стабильность соединения и предсказать его поведение в различных условиях. Применение метода произведения растворимости через ЭДС широко используется в современной химии и аналитике для определения растворимости соединений и расчета электрохимических потенциалов.
ЭДС (электродвижущая сила) возникает при переносе зарядов в электрохимических системах. Для определения произведения растворимости через ЭДС необходимо провести серию экспериментов, измерить ЭДС и затем использовать полученные данные для расчетов. Основная идея метода заключается в том, что ЭДС зависит от концентрации ионов растворенного вещества и может быть использована для определения его растворимости.
Процесс определения произведения растворимости через ЭДС включает несколько этапов:
- Подготовка растворов нужной концентрации и ионной силы. Для этого используются различные методы, например, разведение ионов или смешивание нескольких растворов;
- Измерение ЭДС полученных растворов с помощью специальной электрохимической ячейки или электрода;
- Построение графика зависимости ЭДС от концентрации. Изучение полученной зависимости позволяет найти точку пересечения с осью абсцисс, которая соответствует произведению растворимости;
- Расчет произведения растворимости по полученным данным и использование его для дальнейших расчетов и анализа.
Метод произведения растворимости через ЭДС является эффективным инструментом для определения растворимости ионов и соединений. Он позволяет получить точные и надежные результаты при минимальных затратах времени и ресурсов. Поэтому этот метод широко применяется в научных исследованиях, промышленности и практической химии.
Как определить произведение растворимости через ЭДС

Одним из методов определения Ksp является использование метода электродвижущей силы (ЭДС), основанного на принципе Нернста. Этот метод позволяет определить максимальную получаемую от раствора силу тока и связать ее с Ksp.
Для проведения эксперимента необходимо:
| Материалы | Описание |
|---|---|
| Раствор | Вещество, произведение растворимости которого требуется определить |
| Ион-селективный электрод | Электрод, чувствительный к определенному типу ионов |
| Электрод сравнения | Электрод с известным потенциалом, используемый для сравнения |
| Вольтметр | Прибор для измерения разности электрического потенциала |
| Компьютер с программным обеспечением | Для обработки полученных данных и вычисления Ksp |
Процедура:
- Подготовьте раствор с известной концентрацией ионов вещества, произведение растворимости которого требуется определить.
- Подключите ион-селективный электрод и электрод сравнения к вольтметру.
- Погружайте ион-селективный электрод в раствор и измеряйте разницу потенциалов между электродами.
- Используйте программное обеспечение для обработки данных и вычисления Ksp согласно стандартным уравнениям и зависимостям.
Полученные результаты можно использовать для оценки степени растворимости вещества и его физико-химических свойств. Этот метод является точным и широко применяемым в лабораторных исследованиях.
Электродный потенциал и реакция
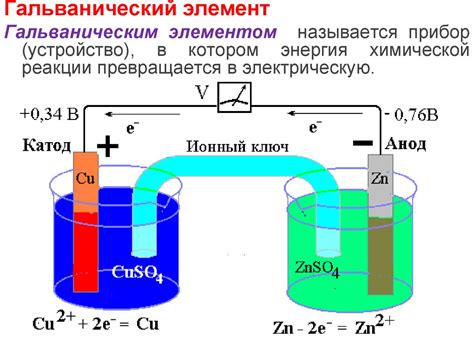
В контексте реакций между веществами, электродный потенциал играет важную роль. Он определяет, протекут ли эти реакции сами по себе или потребуется внешнее воздействие.
Электродный потенциал может быть положительным или отрицательным в отношении стандартного водородного электрода (SHE). Если электродный потенциал положителен, это означает, что вещество обладает способностью получать электроны и восстанавливаться. Если он отрицателен, то вещество имеет способность отдавать электроны и окисляться.
Физическая величина, измеряемая волтами или милливольтами, электродный потенциал может быть определен напрямую с помощью методов, таких как электрохимическая ячейка или электродная потенциометрия.
Интерпретация электродного потенциала важна для понимания химических реакций, таких как окислительно-восстановительные реакции или растворение веществ. Зная электродный потенциал вещества, можно определить его способность отдавать или получать электроны и тем самым предсказать, будет ли реакция протекать самопроизвольно или потребуется внешнее энергетическое воздействие.
Таким образом, электродный потенциал является важной характеристикой вещества и помогает оценить его способность реагировать с другими веществами.
Методы измерения ЭДС

1. Метод сопоставления потенциалов
Этот метод основан на сравнении потенциалов двух электродных систем с помощью вольтметра. Одна система является эталонной, а другая - исследуемой. Путем сопоставления разности потенциалов между эталонной и исследуемой системами можно определить ЭДС.
2. Метод измерения потенциала
Этот метод заключается в измерении разности потенциалов между исследуемым электродом и эталонным электродом с помощью вольтметра или другого подходящего устройства. После измерения разности потенциалов можно вычислить ЭДС.
3. Метод титрования
Этот метод используется для определения ЭДС, основываясь на изменении потенциала при титровании раствора с известной концентрацией вещества. Можно измерять различные значения ЭДС, изменяя концентрацию раствора или тип вещества.
Обратите внимание: для точного и надежного измерения ЭДС необходимо учитывать различные факторы, такие как температура, концентрация и чистота растворов. Поэтому важно выбирать подходящий метод измерения и проводить его с соблюдением соответствующих протоколов и условий эксперимента.



