В нашей жизни множество сил и явлений остаются невидимыми для нашего глаза, но при этом они оказывают огромное влияние на окружающий мир. Одна из таких загадочных сил – катализаторы, неприметные и почти невидимые вещества, которые способны ускорить химические реакции. Истинное влияние катализаторов на превращение веществ остается вопросом, заставляющим ученых размышлять и исследовать различные факторы и механизмы.
Проницательные умы химиков с течением времени заметили, что существуют определенные вещества, способные волшебным образом изменить ход химической реакции. Они вступают во взаимодействие со входящими в реакцию частицами и реорганизуют их, позволяя реакции протекать гораздо быстрее и эффективнее. Катализаторы, будучи отнюдь не просто наблюдателями процесса, активно участвуют в химических превращениях, внося непредсказуемые изменения и позволяя нам добиваться желаемых результатов.
Контролируемое воздействие катализаторов на скорость химических реакций – это малая часть такого грандиозного исследования. Они рисуют нам яркую картину многообразия вещественного мира и заставляют задуматься о том, насколько сложны и запутаны наши процессы превращения одного вещества в другое. Неожиданные факторы и механизмы, взаимодействие различных каталитических систем, уникальные свойства веществ и их сочетание – все эти составляющие формируют загадочный пазл, который требует от нас глубокого погружения и постоянного изучения.
Роль особого компонента в химическом процессе: зависимость скорости реакции от катализатора
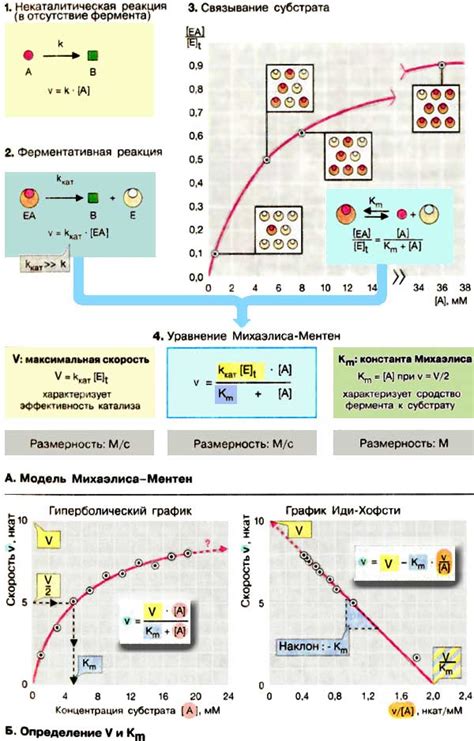
Существует уникальный элемент, способный влиять на скорость химической реакции, однако его роль часто остается непонятной. Установлено, что на протекание реакции может оказывать влияние особый фактор, но механизм воздействия остается претензией на исследования. Этот специальный компонент, часто называемый катализатором, вносит значительные изменения в процесс химической реакции, тем самым влияя на ее скорость и направление протекания.
- Первоначально, катализатор инициирует начало процесса путем активации реагентов, участвующих в реакции. Он может повысить их энергию активации, снижить их стабильность или изменить связи между атомами.
- Кроме того, катализатор способен предоставить альтернативные пути протекания реакции, что делает процесс более эффективным. Он может снизить количество промежуточных стадий, при этом обеспечивая более быстрое образование конечных продуктов.
- Также важно отметить, что катализатор может быть использован многократно в различных реакциях, что делает его экономически выгодным и устойчивым компонентом химического процесса.
В общем, роль катализатора в химической реакции заключается в его способности активировать и изменять ход реакции без затраты на свою собственную потребность. Это является одним из важных факторов, определяющих скорость протекания химического процесса и может быть использовано для ускорения или улучшения реакции в промышленном масштабе.
Роль поверхности катализатора в химической реакции

Успех химической реакции часто зависит от наличия катализатора, но важно уяснить, что не только сам катализатор имеет влияние на скорость процесса, но и его поверхность играет значительную роль. Именно поверхность катализатора вступает в прямой контакт с реагентами, создавая оптимальные условия для протекания реакции.
На поверхности катализатора происходят процессы адсорбции, десорбции и диффузии. Адсорбция, или притягивание реагентов к поверхности, обеспечивает начало химической реакции. Десорбция является обратным процессом, при котором продукты реакции отделяются от поверхности катализатора. И наконец, диффузия позволяет реагентам перемещаться по поверхности катализатора для взаимодействия и формирования новых соединений.
Поверхность катализатора имеет различные физико-химические свойства, такие как активные центры, дефекты и кристаллическая структура, которые влияют на химическую реакцию. Активные центры представляют собой места на поверхности катализатора, где происходит взаимодействие реагентов. Дефекты поверхности могут изменять активность катализатора и снижать энергию активации реакции. Кристаллическая структура влияет на диффузию реагентов между активными центрами.
Однако, поверхность катализатора может изменяться в процессе реакции, например, покрыться слоем продуктов реакции или изменить свою структуру под воздействием реагентов. Это может привести к снижению активности катализатора и замедлению скорости реакции.
- Взаимодействие реагентов с поверхностью катализатора
- Физико-химические свойства поверхности катализатора
- Изменение поверхности катализатора в процессе реакции
Таким образом, роль поверхности катализатора в химической реакции является важным фактором, который определяет скорость и эффективность процесса. Изучение и понимание поверхностных свойств катализатора позволяет улучшить кинетические параметры реакции и использовать катализаторы более эффективно.
Направленное воздействие катализатора на протекание химической реакции
Эффективность направленного действия:
Направленное действие катализатора на реакцию определяется его способностью селективно активировать определенные группы атомов или молекул в исходных реакциях. При этом, катализатор реагирует с определенными связями или промежуточными состояниями, проявляя предпочтительность к определенным степеням окисления или структурным параметрам.
Механизмы направленного воздействия:
Механизмы направленного воздействия катализатора на химическую реакцию могут быть связаны с его физико-химическими свойствами, а также специфичностью активного центра. Катализатор может взаимодействовать непосредственно с молекулами реагента, изменяя их внутреннюю структуру и энергетическое состояние, либо влиять на скорость образования промежуточных соединений.
Факторы, influencing направленного воздействия:
Характеристики катализатора, такие как концентрация, структура поверхности и размер частиц, могут оказывать существенное воздействие на направленность реакции. Окружающая среда также играет важную роль, например, наличие растворителя или использование газофазных катализаторов может изменить экономику реакции и специфичность результатов.
Принципы направленного воздействия:
Реакция, курируемая катализатором, может подчиняться определенным принципам и закономерностям. Некоторые катализаторы ориентируются на превращение реагентов в конкретные продукты, используя уникальные пути, в то время как другие катализируют прямые или обратные реакции в зависимости от условий и первоначальных соединений.
Механизмы взаимодействия катализатора с веществами, участвующими в химической реакции

В данном разделе рассматриваются процессы, которые происходят при взаимодействии катализатора с реагентами. При этом изучаются механизмы, механическая природа и химические процессы, которые происходят на границе контакта катализатора и веществ, участвующих в реакции.
Первый механизм взаимодействия катализатора с реагентами - адсорбция. Адсорбция является процессом притяжения молекул или атомов реагентов к поверхности катализатора. При этом происходит образование химической связи между реагентами и активными центрами катализатора.
Второй механизм - диссоциация. Диссоциация происходит при разложении реагентов на элементарные составляющие при взаимодействии с катализатором. Этот процесс позволяет ускорить скорость химической реакции путем образования более активных и реакционноспособных форм веществ.
Третий механизм - реорганизация. Реорганизация представляет собой изменение молекулярной или атомарной структуры реагентов при взаимодействии с катализатором. В результате этого процесса образуются новые связи и структуры, что способствует протеканию реакции и образованию конечных продуктов.
- Адсорбция - привлечение молекул реагентов к поверхности катализатора
- Диссоциация - разложение реагентов на элементарные составляющие
- Реорганизация - изменение молекулярной или атомарной структуры реагентов
Использование различных механизмов взаимодействия катализаторов с реагентами позволяет эффективно активировать и ускорить протекание химических реакций, что является ключевым фактором в области катализа.
Вопрос-ответ

Как влияет катализатор на скорость химической реакции?
Катализатор ускоряет реакцию, снижая энергию активации. Он облегчает прохождение реагентов через переходное состояние, ускоряя образование продуктов. Благодаря катализатору, реакция может проходить при более низкой температуре и давлении, что улучшает экономическую эффективность процесса.
Какие факторы влияют на эффективность катализатора?
Факторы, влияющие на эффективность катализатора, включают его активность и стабильность. Активность зависит от способности катализатора взаимодействовать с реагентами и образовывать промежуточные соединения. Стабильность определяет, насколько долго катализатор сохраняет свои каталитические свойства.
Каковы механизмы действия катализаторов?
Существуют различные механизмы действия катализаторов. Одним из них является поверхностный катализ, когда реагенты адсорбируются на поверхности катализатора и происходит химическая реакция. Другим механизмом является гомогенный катализ, когда катализатор растворяется в реакционной среде и взаимодействует непосредственно с реагентами.
Как выбрать подходящий катализатор для конкретной реакции?
Выбор подходящего катализатора зависит от характеристик реакции, таких как химический состав реагентов, условия реакции и требования к продуктам. Оптимальный катализатор должен обладать активностью и стабильностью, соответствовать физико-химическим условиям реакции и гарантировать желаемый результат.



