Мысль о том, что вещества могут непохожим образом устроены и обладать разными свойствами, уводит нас в глубины микромира, где складывается само понимание многообразия составов и структур в природе. Исторический развитие учения о строении веществ отражает прогресс в наших знаниях о мире атомов и молекул. Богатый наследник философии эллинизма, современная химия, с ее классификацией и систематизацией веществ, разбивает их на два основных типа – простые и сложные.
Простые вещества представляют собой то, что сохраняет свои химические свойства и структуру при превращениях. Легко проследить аргументацию: ведь кажется, что, если что-то простое, то оно и должно быть простым. И уж тем более простым должно быть его строение и, следовательно, успешно варьирующим свои формы. Простые вещества неразрекаемы неистребимы и не изменимы другими веществами. Они являются основополагающими строительными кирпичиками – атомами веществ. Все это представители разных элементов, которых насчитывается в таблице классической химии в сотни различных видов.
Сложные вещества, в свою очередь, с большей сложностью строятся из нескольких компонентов. Они сочетают в себе элементы и ионы и могут иметь переменное количество атомов каждого элемента. Особенностью сложных веществ является соединение атомов между собой с помощью химических связей. На макроуровне сложные вещества представляют собой гораздо более разнообразные структуры – от живых организмов и их органов до таких нематериальных конструкций, как язык и искусство.
Особенности состава и структуры простых и сложных веществ
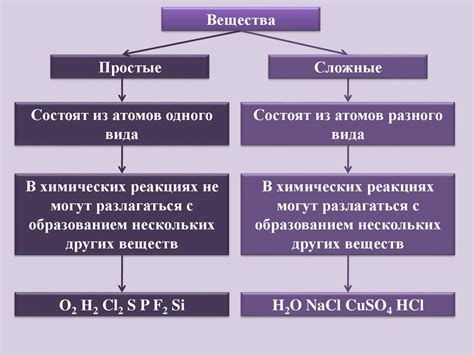
В данном разделе обсуждаются различия между простыми и сложными веществами в отношении их состава и структуры. Простые вещества представляют собой основные химические элементы, которые не могут разложиться на другие вещества. Сложные вещества, в свою очередь, состоят из более чем одного элемента и имеют сложную структуру.
| Простые вещества | Сложные вещества |
|---|---|
| состоят из одного химического элемента | состоят из двух или более химических элементов |
| не подразделяются на части с помощью химических реакций | могут разлагаться на составляющие элементы |
| имеют простую структуру | имеют сложную структуру |
| представлены одной формулой | могут быть представлены различными формулами |
| не могут быть разделены на компоненты | могут быть разделены на компоненты с помощью различных методов |
Простые и сложные вещества играют важную роль в химии и имеют различное поведение при взаимодействии с другими веществами. Понимание их различий в составе и структуре является фундаментальным для понимания основ химических реакций и свойств веществ.
Простые вещества: основные характеристики и свойства

Простые вещества представляют собой элементы, которые не могут быть разложены на более простые компоненты химическими методами. Они являются строительными блоками сложных веществ и играют важную роль в химии. Простые вещества имеют свои уникальные химические и физические свойства, которые позволяют нам классифицировать их по различным характеристикам.
Одной из важных характеристик простых веществ является их атомная структура. Каждый элемент имеет свой уникальный набор атомов, которые определяют его химические свойства. Атомы простых веществ могут быть одиночными атомами или образовывать молекулы, состоящие из двух или более атомов. Важно отметить, что каждый элемент имеет свой уникальный атомный номер и символ, который позволяет его идентифицировать и классифицировать в периодической системе.
Кроме атомной структуры, простые вещества также имеют определенные химические свойства. Они могут образовывать соединения с другими элементами, проводить электрический ток, взаимодействовать с кислотами и щелочами, обладать определенными импульсами и температурными точками плавления и кипения. Эти свойства определяют, как простые вещества взаимодействуют с окружающей средой и какие реакции они могут производить.
Чтобы более полно понять простые вещества и их свойства, необходимо изучать их химический состав и реакции, в которых они участвуют. Это позволяет углубить наши знания о мире атомов и молекул и применить это знание в различных областях науки и технологии.
Состав сложных веществ: соединения элементов и химические формулы
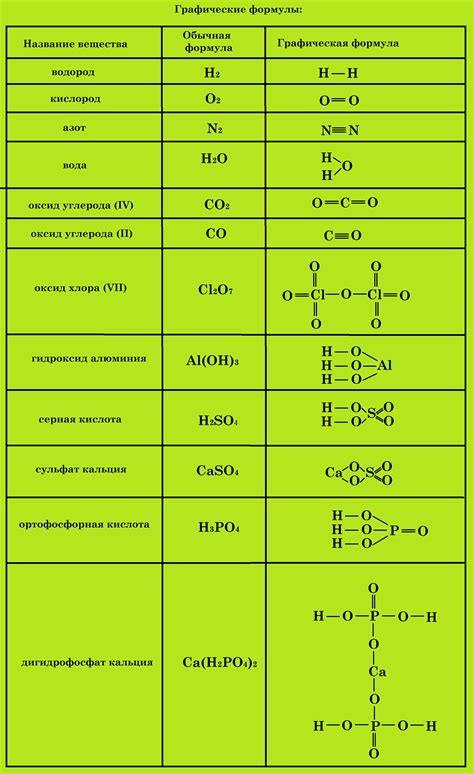
Состав сложных веществ может быть представлен химической формулой, которая отражает количество и тип элементов, включенных в соединение. Химическая формула состава сложного вещества позволяет опознать его и описать его структуру. Она может содержать символы элементов, указывающие на их присутствие в веществе, и индексы, указывающие на количество атомов каждого элемента.
Структурные и физические отличия между молекулярными и ионными соединениями

Изучая химические соединения, важно понять различия в их структуре и свойствах. В этом разделе мы рассмотрим ключевые различия между молекулярными и ионными соединениями, которые играют важную роль в их поведении и применении.
Молекулярные соединения образуются путем соединения атомов разных элементов через химические связи. Атомы, образующие молекулу, могут быть связаны ковалентными связями, обменом электронов, и обычно образуют стабильные и недиссоциативные структуры. Молекулярные соединения имеют определенные пропорции атомов и определенные формулы для представления их состава.
Например, вода (H2O) - это молекула, состоящая из атома кислорода, соединенного с двумя атомами водорода. Вода образуется путем обмена электронами между атомами, создавая прочную ковалентную связь.
Ионные соединения, с другой стороны, образуются путем притяжения положительно и отрицательно заряженных ионов. Атомы в ионных соединениях формируют структуры, которые могут быть пространственно расположены в виде кристаллической решетки. Эти соединения обладают стабильностью в твердом состоянии, но могут диссоциировать в ионы при воздействии на них физических или химических процессов.
Например, хлорид натрия (NaCl) - типичное ионное соединение, состоящее из катиона натрия (Na+) и аниона хлорида (Cl-). В кристаллической решетке каждый ион натрия окружен шестью ионами хлорида, и наоборот.
Кроме того, молекулярные соединения обычно имеют низкую температуру плавления и варятся при относительно низких температурах, так как их структура не подразумевает образования кристаллической решетки. Ионные соединения, в отличие от молекулярных, обладают высокими температурами плавления и кипения, так как необходимо преодолеть сильные притяжения между ионами для изменения их состояния.
Важно отметить, что молекулярные соединения обычно обладают низкой электропроводностью в жидком и твердом состояниях, так как их молекулы не могут проводить электрический ток. Ионные соединения, напротив, обладают высокой электропроводностью в растворенном состоянии или в твердом состоянии при высоких температурах, так как ионы могут перемещаться и проводить электрический ток.
Таким образом, понимание основных различий в структуре и свойствах молекулярных и ионных соединений помогает нам лучше понять их поведение и использование в различных областях науки и технологии.
Реакции образования и разложения: примеры из разных типов веществ
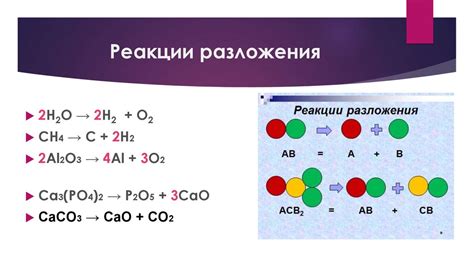
Реакции образования:
Одним из примеров реакций образования является синтез простых водородом и кислородом, что приводит к образованию воды. Вещества в такой реакции объединяются, образуя новое соединение - воду.
Кроме того, в сложных органических веществах могут протекать реакции образования, например, при синтезе этилового спирта из углеводородов. Эта реакция позволяет получить новое соединение - спирт, из элементов, входящих в структуру углеводородов.
Реакции разложения:
Наиболее простым примером реакции разложения является разложение воды на водород и кислород при нагревании. В такой реакции вода распадается на составляющие ее элементы - водород и кислород.
Также, в органических сложных веществах может происходить реакция разложения. Например, разложение глюкозы при низких температурах приводит к образованию углекислого газа и воды. В этом случае, сложное соединение разлагается на более простые компоненты.
Таким образом, реакции образования и разложения проявляются как в простых, так и в сложных веществах, и позволяют образовывать новые соединения или разлагать сложные соединения на более простые элементы.
Вопрос-ответ

В чем заключается разница между простыми и сложными веществами?
Разница между простыми и сложными веществами проявляется в их химическом составе. Простые вещества состоят из атомов одного элемента, тогда как сложные вещества образованы соединением атомов различных элементов.
Какие примеры можно привести простых веществ?
Примерами простых веществ являются элементы периодической таблицы, такие как кислород, азот, водород, железо, серебро и др. Они состоят из атомов одного элемента и не могут быть разложены на более простые вещества.
Какие элементы могут образовывать сложные вещества?
Сложные вещества образуются соединением атомов различных элементов. Примерами таких элементов могут быть кислород, углерод, азот, водород, фосфор и другие. Их сочетание источает возможность образования различных сложных химических соединений.
Какую роль играют связи между атомами при образовании сложных веществ?
Связи между атомами в сложных веществах играют важную роль. Они определяют структуру и свойства сложного соединения. Вид и тип связей между атомами вещества определяют его химическую активность, устойчивость и другие характеристики.