В глубинах нашего мироздания существуют невидимые силы, которые слаженно действуют, чтобы поддерживать устойчивость всего сущего. От яростных вихрей внутри атомов до нежных покачиваний молекул, эти неуловимые силы взаимодействия оказывают огромное влияние на нашу окружающую среду. И, хотя эти процессы могут показаться незаметными, они играют фундаментальную роль в определении свойств всех веществ, от воздуха, которым мы дышим, до камня, на котором мы стоим.
Одной из главных задач науки является понимание и объяснение этих микроскопических, но существенных сил взаимодействия. Они, как пазловая головоломка, являются ключом к разгадке многих загадок природы. Однако, изучение этих сложных процессов требует глубокого понимания молекулярной структуры и поведения, а также аккуратных наблюдений и экспериментов.
Взаимодействия молекул охватывают огромное многообразие процессов, начиная от притяжения и отталкивания, и заканчивая долгосрочным преобразованием. Особое внимание следует уделить межмолекулярным взаимодействиям, таким как ван-дер-Ваальсовы силы, гидрофобные взаимодействия и водородные связи. Все эти силы эффективно управляют структурой и свойствами вещества. Мощные привлекательные и отталкивающие силы, которые действуют на наномасштабах, имеют огромное значение для технологического и научного прогресса, особенно в области нанотехнологий и разработки новых материалов.
От притяжения до отталкивания: влияние молекулярных сил взаимодействия
Одним из ключевых аспектов молекулярных сил взаимодействия является их свойство притягивать молекулы друг к другу. Это притяжение осуществляется за счет различных механизмов, таких как диполь-дипольное взаимодействие, водородная связь и дисперсионные силы. Такие силы оказывают существенное влияние на свойства веществ, включая их физические и химические свойства, а также способность к образованию реакций и реагированию на окружающую среду.
Однако, роль молекулярных сил взаимодействия не ограничивается только притяжением. В некоторых случаях, молекулярные силы могут проявляться в виде отталкивания, что влияет на распределение и движение молекул в системе. Это может приводить к образованию регулярных структур, таких как кристаллические решетки, или наоборот, к разрушению порядка вещества.
Важно отметить, что молекулярные силы взаимодействия обладают значительной силой в мировой микронедоступности, причем их эффекты могут быть незаметны на макроскопическом уровне. Тем не менее, их роль и значение являются неотъемлемой частью понимания и объяснения многих физических и химических процессов.
Притяжение: основные виды сил, действующих на молекулы
Рядом с невооруженным глазом невидимые и таинственные силы, воздействующие на микроскопическом уровне, формируют наш мир и его свойства. В данном разделе мы рассмотрим различные виды притяжения, которые молекулы испытывают и взаимодействуют друг с другом, приводя к разнообразным физическим явлениям.
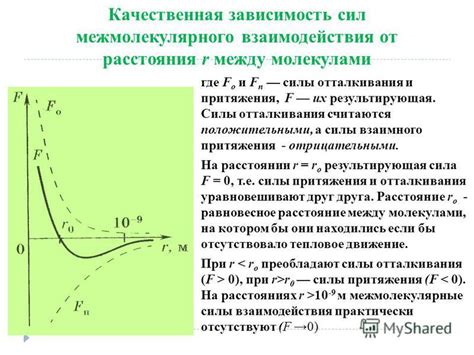
Ван-дер-Ваальсовы силы, хоть и являются слабыми, однако оказывают значительное влияние на поведение молекул. Они возникают благодаря временному несоответствию распределения электронов внутри атомов или молекул и приводят к проявлению некоторой полярности. Эти силы отличаются моментальной природой и могут притягивать или отталкивать молекулы, определяя свойства жидкостей и газов, а также влияя на взаимодействие биологических молекул.
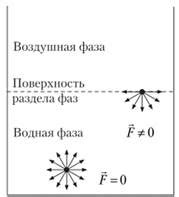
Электростатические силы основаны на взаимодействии электрических зарядов. Положительно и отрицательно заряженные молекулярные группы притягиваются друг к другу, образуя электростатические связи. Эти силы влияют на растворимость солей в воде, а также определяют поверхностные свойства и агрегационное поведение многих веществ.
Гидрофобные силы, жаргонно называемые "отталкивающей силой воды", возникают при взаимодействии неполярных групп молекул с водой. Такие молекулы предпочитают "избегать" контакта с водой и формировать агрегаты с минимальной поверхностью контакта с ней. Это свойство определяет поведение масел, жиров и других неполярных веществ перед водой, а также обуславливает гидрофобность некоторых материалов.
Водородные связи, хоть и являются слабыми, но обладают огромным значением в биологии и химии. В воде, например, такие связи обеспечивают ее уникальные свойства и исключительную способность растворять большинство веществ. Установление водородных связей между молекулами также крайне важно для структуры и функционирования белков, нуклеиновых кислот и других биологически значимых молекул.
Изучение этих основных видов притяжения не только расширяет наше понимание физических явлений, но и открывает возможности для многообразных применений в различных областях науки и технологии.
Отталкивание: сила межмолекулярного отталкивания, которая препятствует объединению

Межмолекулярное отталкивание проявляется в различных видах взаимодействий, таких как статическое и динамическое отталкивание. Статическое отталкивание происходит на молекулярном уровне, когда электронные облака молекул отталкиваются друг от друга, поскольку электронные заряды имеют одинаковый знак. Динамическое отталкивание возникает во время движения молекул, когда они сталкиваются друг с другом и отталкиваются из-за воздействия электронных облаков.
Межмолекулярное отталкивание может существенно влиять на свойства вещества, такие как его плотность, вязкость, поверхностное натяжение и даже агрегатное состояние. Например, в газах межмолекулярное отталкивание препятствует их слипанию и повышает давление газа. В жидкостях межмолекулярное отталкивание создает силу, которая позволяет им сохранять свою форму и поверхностное натяжение. В твердых телах межмолекулярное отталкивание сказывается на их механических свойствах, таких как твердость и упругость.
Изучение межмолекулярного отталкивания позволяет понять, почему некоторые вещества не смешиваются или не растворяются друг в друге, а также приводит к развитию новых материалов с желаемыми свойствами. Понимание и контроль микроскопических сил, таких как межмолекулярное отталкивание, являются важными компонентами современной науки и технологии.
Вопрос-ответ

Какие силы могут взаимодействовать между молекулами?
Межмолекулярные силы включают в себя ван-дер-ваальсовы силы, диполь-дипольные взаимодействия и водородные связи.
Чем отличаются ван-дер-ваальсовы силы от диполь-дипольных взаимодействий?
Ван-дер-ваальсовы силы возникают в результате временного поляризации атомов или молекул под воздействием более электроотрицательных частейц. Диполь-дипольные взаимодействия, в свою очередь, существуют между постоянными диполями молекул.
Как водородные связи влияют на свойства веществ?
Водородные связи обладают большей силой, чем обычные взаимодействия между молекулами. Это позволяет имеющимся таким образом соединениям образовывать сетчатые структуры, более низкую плотность и другие уникальные свойства.
Какие силы формируют поверхностные натяжения и капиллярные явления?
Поверхностные натяжения и капиллярные явления являются результатом доминирования ван-дер-ваальсовых сил и водородных связей на границе раздела между жидкостью и газом, либо жидкостью и твердым телом.
Какие факторы влияют на силы взаимодействия молекул?
Силы взаимодействия молекул зависят от электронной структуры молекул, их формы и свойств среды, таких как температура и давление.