В безграничном пространстве нашей вселенной существует невидимый мир, состоящий из мельчайших частиц и помогающий нам понять устройство материи. Этот скрытый ряд актёров, дареных природой, можно открыть в удивительной химической симфонии, известной как таблица Менделеева. Из объединения этих маленьких строительных блоков, называемых атомами, складывается все, что нас окружает.
Систематическое распределение атомов в таблице Менделеева заключает в себе глубокую гармонию между протонами и электронами. Одни несут положительный заряд, другие - отрицательный, величины которых взаимно сбалансированы, обеспечивая устойчивость атома. Эти мелкие, но изумительно гибкие частицы обладают силой, способной создавать и разрушать, участвуя в различных химических реакциях и обратимых процессах.
Живой организм, нежный цветок, пылающий огонь, все они имеют общее: в каждом из них сокрыты атомы, взаимодействующие друг с другом. Протоны, располагаясь в центре атома, создают его ядро и являются его материнским началом. Электроны, в свою очередь, полетроны, неуловимо парят вокруг ядра, создавая электронную оболочку, которая придает атому его уникальные химические свойства. Вместе эти загадочные силы создают удивительnoе разнообразие химических элементов, представленных в таблице Менделеева.
Периоды и группы в системе расположения элементов
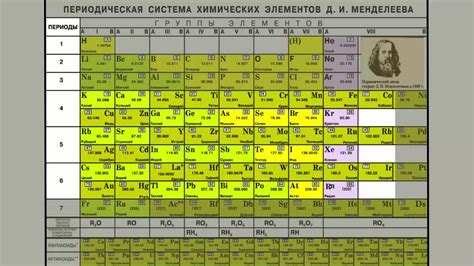
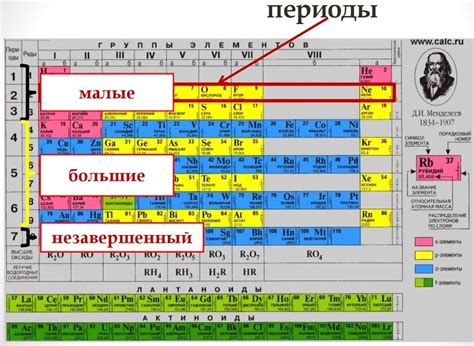
В системе расположения элементов, известной как таблица Менделеева, имеется сложная структура периодов и групп, которая представляет собой удивительную организацию химических элементов. Каждый период и группа имеют свои уникальные характеристики и играют важную роль в понимании химической природы веществ.
Периоды в таблице Менделеева группируют элементы в строчки, расположенные горизонтально, от самого верхнего до самого нижнего ряда. Каждый период имеет свой номер, который соответствует количеству энергетических уровней электронов в атоме элемента. Периоды различаются по количеству электронных оболочек, что влияет на их химические свойства.
Группы, в свою очередь, разделены вертикальными столбцами и имеют номер от 1 до 18. Каждая группа объединяет элементы с похожими химическими свойствами, такими как определенная валентность или сходные реактивности. Группы также могут быть классифицированы по наличию внешней электронной оболочки, что определяет их положение в периодической системе.
Понимание периодов и групп в таблице Менделеева является ключевым фактором для изучения и предсказания химических свойств элементов. Эта структура помогает организовать элементы в логическом порядке и отразить их основные характеристики. Изучение периодов и групп позволяет управлять химическими реакциями, создавать новые материалы и прогнозировать свойства неизвестных элементов.
Распределение электронов по энергетическим уровням

Устройство атома включает в себя сложную систему электронов, которые занимают определенные энергетические уровни. В данном разделе мы рассмотрим, как эти электроны распределяются по уровням и как это связано с их положением в таблице Менделеева.
- Энергетические уровни атома обеспечивают орбитали, на которых находятся электроны.
- Каждый энергетический уровень представляет собой определенную энергию, которую электроны могут иметь.
- Самый ближний уровень к ядру атома называется первым энергетическим уровнем, а самый отдаленный - последним.
- Электроны находятся на уровнях в соответствии с принципом максимальной заполненности, по которому предпочтение отдается наиболее низким энергетическим уровням.
- Распределение электронов по уровням определяет электронную конфигурацию атома, которая играет важную роль в химических свойствах элементов.
- Таблица Менделеева отражает не только номера и массы элементов, но и определенную закономерность в распределении электронов.
Изучение распределения электронов по энергетическим уровням позволяет понять основы строения атомов и их свойства, а также является основой для более глубокого изучения химии и межатомных взаимодействий.
Особенности конфигурации электронов в группах элементов
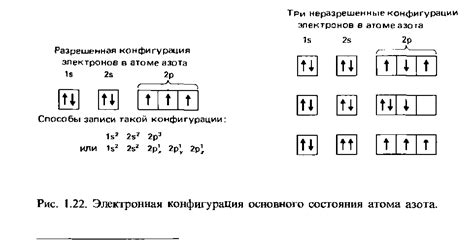
В данном разделе рассмотрим уникальные характеристики распределения электронов в группах элементов, которые влияют на их химические свойства и взаимодействия. Будем изучать не только расположение электронов по энергетическим уровням, но и специфические особенности, которые отличают группы элементов друг от друга.
Проведенные исследования позволили выявить, что количество электронов во внешней электронной оболочке определяет основные химические свойства элемента. В группах элементов таблицы, эти оболочки имеют различные энергетические уровни и разную вместимость по электронам. Это приводит к появлению разнообразных возможностей для образования химических связей и участия в реакциях.
| Группа элементов | Особенности электронной конфигурации | Химические свойства и взаимодействия |
|---|---|---|
| Группа 1 (щелочные металлы) | Один электрон во внешней оболочке | Легко отдают этот электрон, образуя положительные ионы. Обладают высокой реактивностью с водой и кислородом. |
| Группа 14 (углеродные ряды) | Четыре электрона во внешней оболочке | Образуют четыре ковалентные связи и могут формировать различные молекулы огромного разнообразия органических соединений. |
| Группа 18 (инертные газы) | Заполненные внешние оболочки | Не образуют химических связей с другими элементами из-за полного заполнения электронными парами. |
Таким образом, различия в количестве электронов во внешней электронной оболочке и их распределения в группах элементов имеют решающее значение для нашего понимания и объяснения химической активности и характера вещества.
Структура атома: особенности размещения элементарных частиц
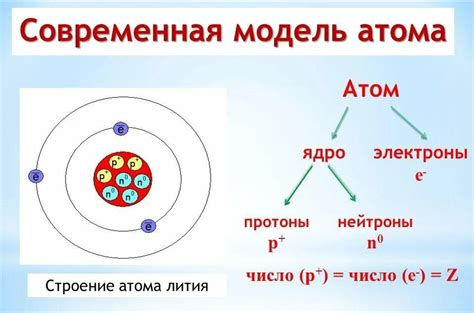
Протоны - это положительно заряженные элементарные частицы, находящиеся в ядре атома. Они являются неотъемлемой частью структуры атома и определяют его химические свойства. Положительный заряд протонов компенсируется отрицательно заряженными электронами, которые находятся в облаке вокруг ядра.
Электроны - это отрицательно заряженные элементарные частицы, которые образуют облако электронов или электронную оболочку атома. Их размещение и движение вокруг ядра определяют энергетические уровни атома и его реактивность. Количество электронов в электронной оболочке зависит от атомного номера элемента и определяет его положение в таблице Менделеева.
Сочетание протонов и электронов в атоме обеспечивает его стабильность и физические свойства. Интересно, что электроны находятся на разных энергетических уровнях, формируя электронные орбитали, в которых возможно их движение и взаимодействие с другими атомами.
Местоположение протонов и электронов в атоме является сложным и хаотичным процессом, и их точные положения в пространстве нельзя определить. Однако, благодаря различным моделям и теориям, мы можем лучше понять и объяснить это удивительное устройство микромира и его взаимодействие с окружающей средой.
Связь между распределением электронов и химическими характеристиками элементов

Каждый элемент в периодической системе характеризуется уникальными химическими свойствами, которые определяют его место и роль в многообразии химических реакций. Существует непосредственная связь между способом, которым электроны распределены по энергетическим уровням атома, и его химическим поведением.
Распределение электронов в атоме важно определить для понимания межатомной связи, взаимодействия с другими элементами и возможности образования соединений. Химические свойства, такие как валентность, атомный радиус, способность к образованию ионов и ковалентных связей напрямую зависят от количества электронов на внешнем энергетическом уровне атома.
Классификация элементов по их электронной конфигурации позволяет выявить закономерности в их химическом поведении. Элементы, расположенные в одной группе таблицы, имеют одинаковое количество электронов на внешнем энергетическом уровне и, следовательно, демонстрируют сходные химические свойства.
Более общая зависимость может быть обнаружена при рассмотрении элементов внутри периодов таблицы. Периодическое повторение химических свойств элементов связано с последовательным заполнением энергетических уровней атома электронами, что ведет к изменению их химической активности.
- Элементы, расположенные слева и снизу в таблице, имеют малое количество электронов на внешнем энергетическом уровне. Они обладают большой активностью и усиленной способностью образовывать ионы с положительным зарядом.
- Элементы, расположенные справа и вверху таблицы, имеют более заполненные внешние энергетические уровни. Они обладают меньшей химической активностью и обычно образуют соединения с отрицательно заряженными ионами или обмениваются электронами, чтобы достичь полности заполненной оболочки.
Подводя итог, можно сказать, что распределение электронов по энергетическим уровням атома Менделеева неразрывно связано с химическими свойствами элементов. Изучение этой связи помогает предсказывать и объяснять химическое поведение различных элементов и их реакционную способность.
Распределение электронов в подуровнях s, p, d, f
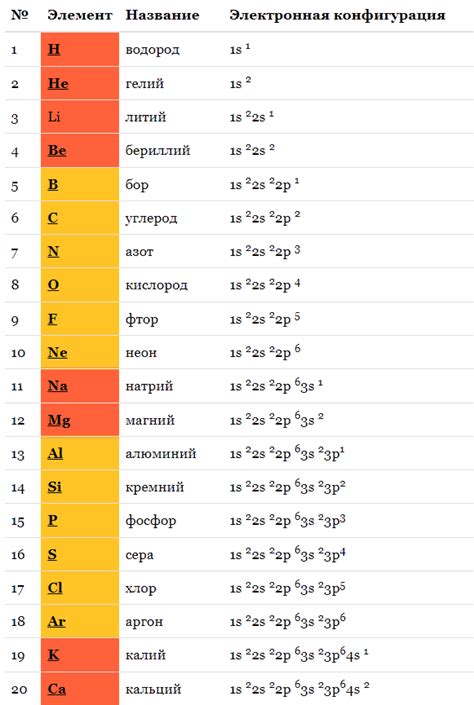
Внутри атомов находятся заряженные частицы, называемые электронами. Они окружают ядро атома, составленное из протонов и нейтронов. Атомы разных элементов могут иметь разное количество электронов, и эти электроны располагаются на различных энергетических уровнях и подуровнях.
Подуровни электронов обозначаются буквами s, p, d, f. Каждый из них имеет свои особенности и может содержать определенное количество электронов. Распределение электронов в подуровнях определяет электронную конфигурацию атома.
- Подуровень s – это самый простой и наиболее близкий к ядру. Он может вместить до 2 электронов.
- Подуровень p – находится на некотором расстоянии от ядра и способен вместить до 6 электронов.
- Подуровень d – уже более удаленный от ядра, может вмещать до 10 электронов.
- Подуровень f – самый дальний от ядра, способен вместить до 14 электронов.
Распределение электронов в подуровнях s, p, d, f является важным и определяет химические свойства элементов. Это распределение может быть представлено в виде электронной конфигурации, которая отображает количество электронов в каждом подуровне.
Взаимодействие протонов и электронов в химических реакциях

Протоны и электроны играют важную роль в превращении одних веществ в другие в результате химических реакций. Протоны, являющиеся положительно заряженными частицами, и негативно заряженные электроны обладают привлекательными и отталкивающими свойствами, которые определяют их взаимодействие внутри атомов и молекул.
В процессе химической реакции, протоны и электроны перегруппируются, образующие новые химические связи и структуры. Положительные протоны смещаются к негативным электронам, создавая ионы, атомы, или молекулы, с измененными физическими и химическими свойствами. Этот процесс не только приводит к образованию новых веществ, но и сопровождается выделением или поглощением энергии.
Важно отметить, что взаимодействие протонов и электронов в химических реакциях определяется их расположением в атомах или ионах. Определенное количество протонов и электронов в определенном порядке влияет на структуру и стабильность вещества. Число протонов в ядре атома определяет его атомный номер, который в свою очередь определяет его положение в таблице Менделеева и свойства элемента. Электроны, находящиеся в энергетических оболочках атомов, играют важную роль во взаимодействии с другими атомами, образуя химические связи и определяя химическую активность и реакционную способность вещества.
Взаимосвязь химической активности элементов и особенностей их внешней электронной оболочки
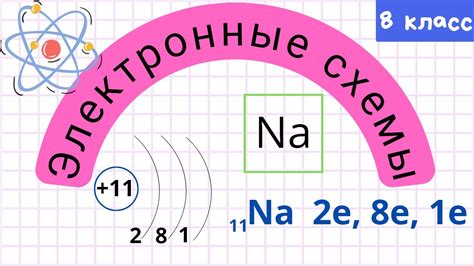
При изучении химических свойств элементов чрезвычайно важно обратить внимание на их внешнюю электронную оболочку. Это строение, состоящее из электронов, играет ключевую роль в химических реакциях и взаимодействии элементов с другими веществами. Внешние электроны определяют химическую активность элементов, и разные особенности их расположения в таблице Менделеева приводят к различиям в их взаимодействии с окружающей средой.
- Положение в таблице Менделеева
- Влияние внешних электронов на химическую активность
- Тенденции в изменении химической активности
Разные группы элементов в таблице Менделеева имеют разные химические свойства, что обусловлено их внешней электронной структурой. Элементы в одной группе имеют одинаковое количество электронов во внешней оболочке, но разное количество электронов во внутренних оболочках. Такое распределение электронов делает элементы группы химически похожими и определяет их общую химическую активность.
Количество и конфигурация внешних электронов определяют способность атомов элементов образовывать связи с другими атомами и участвовать в химических реакциях. Элементы с полностью заполненной внешней оболочкой (нобелевские газы) имеют низкую химическую активность, так как они не образуют химические связи. С другой стороны, элементы с неполностью заполненной внешней оболочкой стремятся завершить ее, образуя связи с другими элементами.
В таблице Менделеева можно наблюдать определенные тенденции в изменении химической активности элементов. Например, химическая активность возрастает при движении от верхнего левого угла таблицы Менделеева к нижнему правому углу. Эта тенденция связана с увеличением количества внешних электронов и уменьшением энергии их удерживания ядром в атоме. Также можно проследить изменение химической активности в пределах одной группы элементов, связанное с изменением числа электронов во внешней оболочке.
Исходя из вышесказанного, становится очевидным, что внешняя электронная оболочка является одним из главных факторов, определяющих химическую активность элементов. Понимание особенностей расположения и взаимодействия электронов взаимосвязано с изучением химических свойств элементов и является фундаментальной основой современной химии.
Значимость атомной структуры в системе классификации элементов в химии и материаловедении
Атомы каждого элемента имеют разное количество электронов, образующих электронные орбитали. Взаимодействие этих орбиталей определяет расположение элементов в системе Менделеева, где они группируются в соответствии с их электронной конфигурацией.
- Протоны и электроны, представленные атомными частицами, играют важную роль в определении свойств материалов, так как заряд протонов и расположение электронов в атомной оболочке влияют на химическую активность и реакционную способность элементов.
- Электронная структура атомов также влияет на физические свойства материалов, такие как проводимость электричества или теплопроводность, так как она определяет, как электроны могут передвигаться и взаимодействовать друг с другом.
- Расположение элементов в таблице Менделеева позволяет устанавливать связи между свойствами различных элементов и их местом в периодической системе, что позволяет предсказывать и объяснять химические реакции и физическое поведение веществ.
Таким образом, электронная структура атомов и их расположение в таблице Менделеева являются важными основами химии и материаловедения, позволяющими понять и классифицировать элементы, предсказывать их свойства и исследовать новые вещества и материалы с определенными характеристиками и функциями.
Вопрос-ответ

Что такое таблица Менделеева и как в ней расположены протоны и электроны?
Таблица Менделеева – это систематическое представление химических элементов, где они упорядочены по возрастанию атомных номеров. Протоны (положительно заряженные частицы) находятся в ядре атома, а электроны (отрицательно заряженные частицы) располагаются вокруг ядра по энергетическим уровням, называемым оболочками.
Почему протоны и электроны имеют разную зарядность?
Протоны и электроны имеют противоположную зарядность, так как электрический заряд элементарных частиц называется положительным для протонов и отрицательным для электронов. Это свойство внутренней структуры атома, которое обуславливает взаимодействие между частицами и определяет химические свойства элементов.
Влияет ли расположение протонов и электронов в таблице Менделеева на химические свойства элементов?
Да, расположение протонов и электронов в таблице Менделеева имеет прямое влияние на химические свойства элементов. Количество протонов определяет атомный номер элемента и его положение в таблице, а количество электронов определяет электронную конфигурацию атома, что влияет на его химическую активность и способность образовывать химические соединения.