Когда мы рассматриваем устройство и строение периодической таблицы элементов, нам часто представляется невероятная сложность и максимальная точность, к которым стремятся ученые. Ведь как между этими множеством знаков, символов и чисел можно увидеть закономерности и находить связи между элементами? Вот и наше внимание привлекает расположение металлов, которое является одним из главных аспектов в этой гигантской химической системе.
Внешний вид периодической таблицы, украшенный знаками разнообразных элементов, кажется внушительным лабиринтом определений и терминов. Однако, скрываясь за сложностью, здесь присутствует элементарная элегантность и магия, которая приводит нас к пониманию, что каждый элемент расположен в своем месте с предназначением, подобно фигуре на шахматной доске. Это также относится и к стройному массиву металлических элементов, которые играют важную роль в химических реакциях, формируя новые соединения с уникальными свойствами.
Когда мы говорим о распределении металлов в периодической системе элементов, мы заставляем себя заглянуть внутрь калейдоскопа, где каждый выделенный элемент дает свою ноту, свою роль и свою значимость. Взглянув поверхностно, можно заметить, что эти элементы обладают кондуктивностью, теплопроводностью и блеском, что вызывает в нас ассоциации с силой, величием и значительностью. Однако, если мы вглядимся глубже и начнем исследовать их химические свойства, мы откроем перед собой сокровищницу необычных соединений с примесью магии и тайны, которую так любят раскрывать ученые.
Периодическая система элементов: одним из ключевых инструментов химического анализа
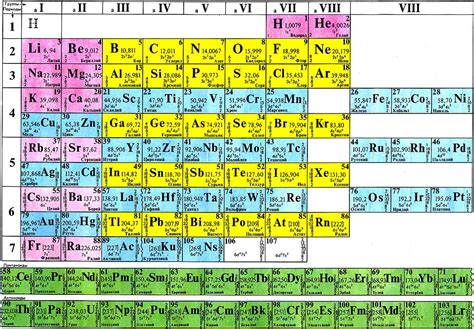
Периодическая система элементов представляет собой важнейший ориентир в области химии и становится неотъемлемой частью образования в области естественных наук. Ее уникальное составление и расположение элементов позволяют химикам определить закономерности и свойства веществ, исследовать реакции и процессы в молекулярном мире.
Периодическая система элементов является удивительной картой химических элементов, разбросанных вокруг нас. Здесь каждый элемент представлен символом и атомным номером, отражающим его порядковый номер в системе. Важно отметить, что периодическая система не включает в себя только металлы, но и несколько других классов элементов, таких как неметаллы и полуметаллы.
Благодаря структуре периодической системы химики могут легко определить химические свойства элементов, включая их реакционную способность, электроотрицательность и тепловые свойства. Например, благодаря единственной системе можно сравнивать металлы и изучать их общие характеристики, такие как хорошая электропроводность, высокие плавление и кипение, а также способность образовывать положительные ионы.
Важно отметить, что периодическая система элементов является основой для различных областей науки, включая органическую химию, неорганическую химию, физику и даже биологию. Она позволяет исследователям строить гипотезы, проводить эксперименты и делать прогнозы о новых веществах и реакциях, что способствует прогрессу в науке и промышленности.
Таким образом, периодическая система элементов является неотъемлемым инструментом химии, обеспечивая химиков и исследователей мощным средством для понимания и управления миром атомов и молекул.
Взаимное расположение металлических элементов в структуре Периодической таблицы
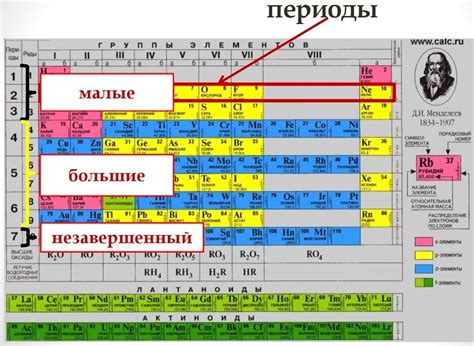
Исследование взаимного размещения металлов внутри Периодической таблицы непременно поможет нам понять, какие общие тенденции и связи существуют между этими элементами. Благодаря этому пониманию, мы сможем заранее предсказывать реакционную активность различных металлических элементов, а также их способность образовывать соединения с другими веществами.
Наиболее важными аспектами рассмотрения являются сходства и различия между металлами в разных группах и периодах Периодической таблицы. Благодаря глубокому анализу этих свойств, мы сможем определить основные закономерности, которые объединяют металлы своего класса, и установим их общие черты. Дополнительно, изучение положения металлов будет помогать нам понять, почему отдельные элементы проявляют определенные химические свойства, включая их склонность к окислению, образованию ионов и способностью сопротивляться коррозии.
В этой статье наши усилия будут сосредоточены на детальном рассмотрении местоположения металлов, их определенных групп и периодов в структуре Периодической таблицы. Более конкретно, будут рассмотрены металлы s-блока, d-блока и f-блока, их характеристики и связанные с ними химические свойства. Используя эту информацию, вы сможете расширить свое понимание о металлах в Периодической таблице и их основных свойствах.
Особенности распределения металлов в Периодической системе элементов

В данном разделе рассмотрим основные особенности и закономерности, которые характерны для размещения металлов в Периодической системе, отметив их важные химические свойства.
Одной из главных характеристик, определяющих распределение металлов в Периодической системе, является их атомное строение. Металлы обладают четкой границей между сферами внутренних и внешних электронов. Внешняя оболочка металлов включает от одного до трех валентных электронов, что является причиной высокой реакционной способности металлов.
Другим важным аспектом является связь между положением металла в Периодической системе и его химическими свойствами. Например, металлы в левой части Периодической системы, такие как щелочные и щелочноземельные металлы, обладают высокой активностью и легко образуют ионы положительного заряда. С другой стороны, переходные металлы располагаются в середине Периодической системы и отличаются большим разнообразием химических свойств, таких как способность образовывать соединения с различными степенями окисления.
Нельзя не отметить, что с увеличением атомного номера металла в Периодической системе его металлические свойства также могут изменяться. Например, к последним металлам в Периодической системе относятся платиновые металлы, которые характеризуются высокой плотностью, тугоплавкостью и химической инертностью.
Группировка металлов в Периодической системе происходит по некоторым закономерностям. Например, в группе платиновых металлов расположены элементы с аналогичной структурой внешней оболочки и схожими химическими свойствами. Такое распределение позволяет упростить систематизацию металлов и предсказывать их химическую активность.
Типы металлов и их химические особенности

Один из интересных аспектов, связанных с химией металлов, заключается в их разнообразии и уникальных химических свойствах. Среди них можно выделить несколько основных типов металлов, каждый из которых обладает своими характерными особенностями и химическими реакциями.
| Тип металла | Химические особенности |
|---|---|
| Щелочные металлы | Отличаются высокой реактивностью и способностью легко образовывать ионы положительного заряда. Характеризуются активными реакциями с водой и кислотами. |
| Щелочноземельные металлы | Подобно щелочным металлам, образуют ионы положительного заряда, но их реактивность ниже. Часто используются в различных сплавах и соединениях. |
| Переходные металлы | Характеризуются изменением степени окисления и способностью образовывать комплексные соединения. Обладают разнообразными физическими и химическими свойствами. |
| Постпереходные металлы | Отличаются разнообразием атомных строений и химических свойств. Многие из них имеют малую плотность и низкую температуру плавления. |
| Лантаноиды и актиноиды | Эти две серии металлов характеризуются наличием внутренних электронных оболочек и разнообразными окислительными состояниями. Используются в различных технических приложениях. |
Это лишь общий обзор типов металлов и их химических особенностей. Детальное изучение каждого типа позволяет по-настоящему погрузиться в раскрытие удивительной химии данных элементов.
Химические особенности различных металлов: различия и схожести

В данном разделе мы рассмотрим уникальные химические свойства разных металлов, которые отличают их от других элементов в периодической системе веществ. Несмотря на общие черты, каждый металл обладает индивидуальными особенностями, определяющими его поведение в химических реакциях и взаимодействии с другими веществами.
Одним из наиболее заметных приметных признаков, различающих металлы, является их групповая принадлежность. Некоторые металлы имеют схожие свойства и химическую активность, если они расположены в одной группе периодической системы. Например, щелочные металлы, такие как литий, натрий и калий, обладают схожими химическими свойствами, такими как способность реагировать с водой и создавать щелочные растворы.
Тем не менее, даже металлы, находящиеся в одной группе, могут иметь различия в своем поведении. Например, медь и серебро, которые являются переходными металлами, могут образовывать соединения с разными степенями окисления, что влияет на их реактивность и способность к образованию соединений с другими элементами.
Кроме того, металлы также могут отличаться по своей степени реактивности. Некоторые металлы, такие как калий, натрий и цезий, являются очень реактивными и легко взаимодействуют с кислородом воздуха, образуя оксиды металлов. В то же время, некоторые переходные металлы, такие как железо и медь, более устойчивы к окислению и могут быть использованы для создания защитных покрытий или конструкций, устойчивых к коррозии.
Однако, несмотря на все различия между металлами, у них также есть общие химические черты. Например, большинство металлов обладает хорошей теплопроводностью и электропроводностью, а также имеет металлический блеск и способность образовывать положительные ионы в растворах.
- Металлы могут иметь схожие свойства, если они принадлежат к одной группе периодической системы
- Металлы могут иметь различия в своем химическом поведении, даже если они находятся в одной группе
- Металлы могут различаться по своей реактивности и способности к образованию соединений
- Металлы имеют общие черты, такие как хорошую теплопроводность и электропроводность
Важность металлов в процессах химических реакций

Металлы, являющиеся ключевыми элементами периодической таблицы, играют существенную роль во многих химических реакциях. Они обладают уникальными свойствами и способностями, которые влияют на ход и итоги различных процессов.
Первая и наиболее важная функция металлов в химических реакциях - это их способность действовать в качестве катализаторов. Металлы могут быстро активировать реагенты и ускорять скорость реакции, участвуя в формировании промежуточных комплексов. Эта способность позволяет металлам играть решающую роль в различных промышленных процессах и синтезе важных химических соединений.
Второе важное свойство металлов - их способность образовывать ионы различных степеней окисления. Ионы металлов могут служить как восстановителями, принимая электроны, так и окислителями, отдающими электроны. Благодаря этой способности, металлы активно участвуют в окислительно-восстановительных реакциях, проявляя свою химическую активность.
Кроме того, металлы имеют высокую электропроводность и теплопроводность, что делает их отличными материалами для использования в электрических и термических устройствах. Благодаря своей способности переносить ток, металлы играют важную роль в электролизе и электрохимических процессах.
Также, металлические соединения широко применяются в качестве каталитических материалов в различных промышленных процессах и для синтеза органических соединений. Металлы играют ключевую роль в процессах гидрогенирования, окисления, гидратации, апротонной реакции, а также в реакциях соединения соединений с неорганическими кислотами.
Вопрос-ответ

Какие закономерности и особенности определяют расположение металлов в периодической системе элементов?
Расположение металлов в периодической системе элементов определяется рядом закономерностей и особенностей. Во-первых, металлы находятся слева от главной группы элементов и обладают отличными от неметаллов физическими и химическими свойствами. Они обладают высокой электропроводностью, термической и электрической аттракцией. Во-вторых, металлы характеризуются положительными значениями электроотрицательности, что связано с их способностью отдавать электроны другим элементам при химических реакциях. Также, в периодической таблице металлы располагаются в порядке увеличения атомного номера с лева направо и снизу вверх.
Какие химические свойства характерны для металлов в периодической системе элементов?
У металлов в периодической системе элементов есть несколько характерных химических свойств. Во-первых, металлы обладают способностью образовывать ионные соединения с неметаллами, отдавая электроны и образуя положительно заряженные ионы. Они также способны образовывать ковалентные связи и создавать комплексные соединения с другими элементами. Во-вторых, металлы имеют способность проявлять металлический блеск и быть хорошими проводниками тепла и электричества. Они также обладают пластичностью и формируют кристаллическую решетку. Кроме того, металлы могут проявлять различные окислительные свойства и способны образовывать соли с кислотами.
Каково значение расположения металлов в периодической системе элементов для изучения химии и промышленности?
Расположение металлов в периодической системе элементов имеет огромное значение для изучения химии и промышленности. Оно позволяет установить систематику и классификацию элементов в зависимости от их химических и физических свойств. Это облегчает понимание реактивности металлов, их способности образовывать сплавы и соединения с другими элементами. Расположение металлов также помогает определять возможные применения металлических материалов в различных областях, таких как строительство, электроника, медицина и многие другие. Благодаря расположению металлов в периодической системе элементов мы можем предсказывать их свойства и использовать их в различных сферах жизни.