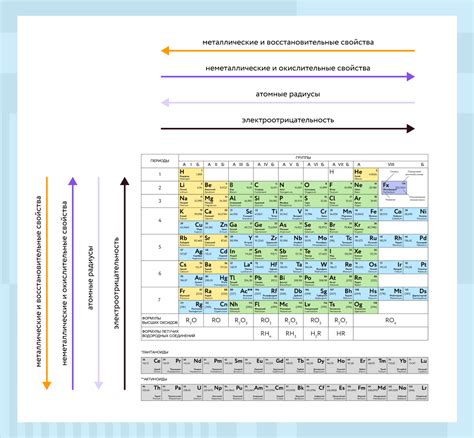
Как самые электроотрицательные элементы, галогены занимают свое особое место в периодической системе. Они обладают высокой восстановительной активностью, способностью образовывать соли и тугоплавкостью. Однако, изучение их позиции в таблице Менделеева может раскрывать неожиданные и интересные особенности. Появление галогенов в периодической системе может быть описано через общее состояние атомов и их электронную конфигурацию.
Будучи расположенными в последнем (p-оболочке), галогены демонстрируют устойчивость к взаимодействию. Это означает, что атомы галогенов ведут себя достаточно инертно и редко могут быть обнаружены в свободном состоянии в природе. Однако, их восстановительная активность возрастает по мере движения вниз по группе, основанной на изменении энергетической структуры электронов. Поэтому, в периодической таблице, галогены занимают позиции снизу вверх, что позволяет им проявлять свою уникальность и важность.
Электронная конфигурация и размеры атомов галогенов также играют важную роль в их расположении в периодической системе. Эти элементы обладают седьмым электроном, находящимся на внешнем p-уровне энергии. По мере увеличения атомного номера, размеры атомов галогенов увеличиваются благодаря добавлению дополнительных слоев электронов. Это явление также влияет на их химическую активность и способность образовывать связи с другими элементами в таблице.
Позиция электроотрицательных элементов в системе химических элементов
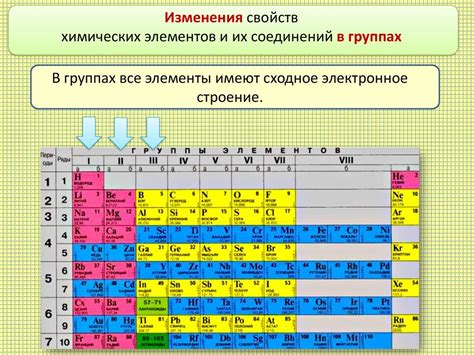
В периодической системе элементов имеется особая группа элементов, обладающих высокой электроотрицательностью. Эти элементы известны как иногда называемые "электроотрицательные галогены".
Среди этих элементов можно выделить фтор, хлор, бром и йод. Они занимают одну из наиболее "активных" позиций в периодической системе. Свою электроотрицательность они получают за счет наличия одного свободного электронного слоя, который эти элементы готовы "отдать" во время химических реакций.
Эти элементы находятся во второй группе периодической системы, следующей за группой щелочных металлов. Они отличаются от них тем, что имеют стабильную электронную конфигурацию внешнего слоя, состоящего из семи электронов.
| Элемент | Атомный номер | Символ |
|---|---|---|
| Фтор | 9 | F |
| Хлор | 17 | Cl |
| Бром | 35 | Br |
| Йод | 53 | I |
Галогены обладают одними из самых сильных химических свойств среди всех элементов в периодической системе. Они образуют со многими другими элементами соединения, которые обладают широкими применениями в промышленности, медицине и других отраслях. Более подробное изучение их свойств очень важно для нашего понимания химии и возможностей их использования в будущих технологиях.
Химические свойства элементов, рассположенных в фтор-силоноидной группе периодической системы
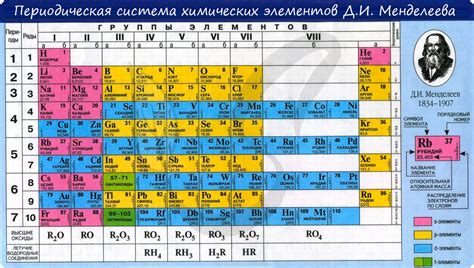
В данном разделе мы рассмотрим свойства химической активности элементов, которые занимают важное положение в фтор-силоноидной группе периодической системы. Эти элементы обладают сходными химическими свойствами и образуют галогены.
Галогены - это элементы, отличающиеся высокой электроотрицательностью, что делает их сильными окислителями и деполимеризаторами. Велика их химическая активность, объясняющаяся наличием семь электронов во внешней электронной оболочке. Из всех элементов галогеновой группы лидером по активности является фтор.
Фтор, расположенный в самом верху группы, обладает наибольшей электроотрицательностью и считается самым активным из всех элементов. Его высокая активность объясняется тем, что он стремится заполнить свою внешнюю электронную оболочку, имеющую лишь один валентный электронный слой. Фтор способен вступать в реакции с практически любым другим элементом, включая обычные неорганические вещества, что делает его незаменимым компонентом во многих промышленных процессах.
Хлор, следующий по активности элемент, также обладает высокой электроотрицательностью и активностью, однако ниже, чем у фтора. Хлор способен образовывать соединения с большинством тех элементов, которые расположены в таблице выше его.
Остальные два элемента группы - бром и йод - также проявляют химическую активность, характерную для галогенов. Бром обладает менее высокой электроотрицательностью, чем фтор и хлор, поэтому его активность несколько ниже. Йод же, самый большой и самый тяжелый элемент группы, обладает наименьшей электроотрицательностью и активностью, но его соединения все равно могут проявлять значительные химические свойства.
Физические свойства флуора, хлора, брома и йода

В этом разделе мы рассмотрим основные физические характеристики четырех элементов, относящихся к группе галогенов в периодической системе элементов. Рассмотрим их физические свойства, включая агрегатные состояния, плотность, температуру плавления и кипения, а также посмотрим на их электроотрицательность и электронную конфигурацию.
| Элемент | Агрегатное состояние | Плотность | Температура плавления | Температура кипения | Электроотрицательность | Электронная конфигурация |
|---|---|---|---|---|---|---|
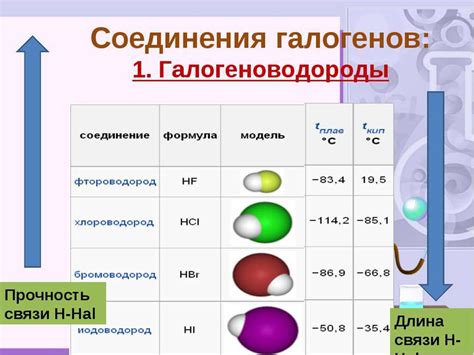
| Флуор | Газ | 1,7 г/л | -219 °C | -188 °C | 3,98 | [He] 2s^2 2p^5 |
| Хлор | Газ | 2,95 г/л | -101 °C | -34 °C | 3,16 | [Ne] 3s^2 3p^5 |
| Бром | Жидкость | 3,12 г/см³ | -7 °C | 59 °C | 2,96 | [Ar] 3d^10 4s^2 4p^5 |
| Йод | Твердое тело | 4,93 г/см³ | 114 °C | 184 °C | 2,66 | [Kr] 4d^10 5s^2 5p^5 |
Флуор, хлор, бром и йод - галогены, которые расположены в последней группе периодической системы элементов. Каждый из них имеет свои уникальные свойства, которые определяются их строением, электронной конфигурацией и взаимодействием с другими элементами. Например, флуор является газом при комнатной температуре и обладает высокой электроотрицательностью, что делает его мощным окислителем. Хлор также является газом, но раздражающим для слизистых оболочек. Бром - единственный из галогенов, который образует жидкость при комнатной температуре, а йод - твердое вещество с фиолетовым оттенком. Изучение физических свойств галогенов позволяет лучше понять их химическую активность и применение в различных областях науки и техники.
Особенности реактивности элементов VIIA группы
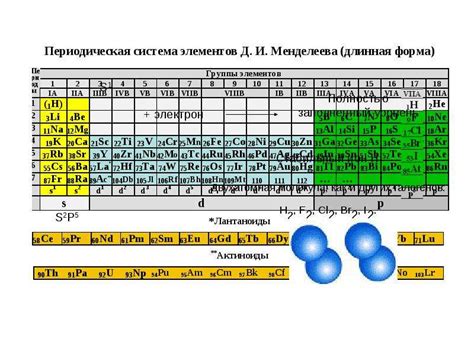
В данном разделе рассмотрим особенности химической активности элементов, расположенных в седьмой группе периодической системы элементов. Они известны также как элементы VIIA группы, характеризующиеся высокой электроотрицательностью и большой реакционной способностью.
Одной из основных особенностей реактивности галогенов является их способность к образованию сильных окислителей. Они способны легко отстаивать электроны от других элементов, что делает их мощными окислителями во многих реакциях. Это свойство обусловлено их высокой электроотрицательностью и их способностью принимать электроны, образуя галогенидные ионы.
Важной особенностью галогенов является их высокая реакционная способность со многими элементами. Они могут вступать во множество реакций, включая горение, замещение и образование солей. Например, галогены легко реагируют с металлами, образуя их галогениды. Также они могут вступать в реакции с неорганическими и органическими соединениями, образуя новые соединения с различными свойствами.
Еще одной важной особенностью реактивности галогенов является их способность к образованию кислот. Водные растворы галогенов обладают кислотными свойствами, что проявляется в возникновении кислого реакцентного окружения. Это свойство обусловлено способностью галогенов образовывать кислородсодержащие кислоты, такие как хлорные, бромные и йодные кислоты, которые обладают выраженной кислотностью.
- Высокая электроотрицательность и способность к образованию галогенидных ионов
- Способность к образованию сильных окислителей
- Реакционная способность с различными элементами и соединениями
- Образование кислотных растворов
Роль галогенных элементов в химической промышленности

Позиция определенной группы химических элементов в периодической таблице имеет важное значение для процессов, связанных с производством различных химических соединений. Рассмотрим значимость галогенных элементов в химической промышленности.
Галогены - это группа химических элементов, включающая фтор, хлор, бром, йод и астат. Они расположены на самом верхнем правом углу периодической таблицы. Галогены широко используются в химической промышленности благодаря своим уникальным свойствам и возможности образования стабильных соединений с другими элементами.
Фтор, самый электроотрицательный элемент в таблице, находит применение в производстве фторированных органических соединений, полимеров, травогазующих веществ, лекарств, а также в процессах очистки и дезинфекции воды.
Хлор, второй по электроотрицательности элемент, используется для производства пластмасс, хлорорганических соединений, солепромывных средств, а также в очистке и дезинфекции питьевой воды.
Бром, менее электроотрицательный элемент, находит применение в производстве огнезащитных материалов, фотографии, лекарств, а также в очистке и дезинфекции бассейнов.
Йод и астат, самые тяжелые элементы группы, используются в производстве лекарств, рентгеновских источников, а также в исследованиях в области радиоактивности и ядерной энергетики.
| Галоген | Применение в химической промышленности |
|---|---|
| Фтор | Фторированные органические соединения, полимеры, травогазующие вещества, лекарства, очистка и дезинфекция воды. |
| Хлор | Пластмассы, хлорорганические соединения, солепромывные средства, очистка и дезинфекция воды. |
| Бром | Огнезащитные материалы, фотография, лекарства, очистка и дезинфекция бассейнов. |
| Йод | Лекарства, рентгеновские источники, исследования в области радиоактивности и ядерной энергетики. |
Взаимодействие химических элементов группы VII с прочими веществами
В данном разделе мы рассмотрим, как элементы, относящиеся к группе VII периодической системы, взаимодействуют с различными химическими элементами и соединениями. Группа VII, также известная как группа галогенов, включает элементы, обладающие высокой реактивностью и характерными химическими свойствами.
Группа VII включает фтор, хлор, бром, йод и астат. Каждый из этих галогенов обладает уникальными свойствами и способностью формировать разные химические соединения. Галогены обладают высокой электроотрицательностью, что определяет их способность к образованию сильно поляризующих связей и химическим реакциям.
Взаимодействие галогенов с металлами и неметаллами имеет свои особенности. Галогены образуют с металлами ионные соединения, при этом вытесняя друг друга в ряду по возрастанию электроотрицательности. Кроме того, галогены способны вступать в реакции с неметаллическими элементами, образуя химические соединения разнообразной природы.
Важной особенностью галогенов является их способность образовывать галогениды с водородом, которые нередко обладают характерными запахом и цветом. Также галогены могут вступать в реакции с гидридами, оксидами и кислотами, образуя разнообразные химические соединения с различными свойствами и применениями.
Сравнение свойств элементов группы галогенов и их взаимодействие с другими элементами
В данном разделе мы рассмотрим основные особенности и характеристики группы химических элементов, известных как галогены, и сравним их свойства внутри группы и взаимодействие с другими элементами.
- Положение галогенов в таблице элементов: принадлежность к 17-й группе химического элементов.
- Химические свойства галогенов: высокая реактивность, склонность к образованию солей и соединений с металлами.
- Внутригрупповые свойства: сравнение электроотрицательности, радиуса атомов и ионов, энергии ионизации, а также электрохимической активности галогенов.
- Взаимодействия с другими элементами: их реакционная способность и возможность образования химических соединений, включая галогены как окислители или восстановители.
- Сравнение свойств галогенов с другими группами элементов: сравнение химической активности, электроотрицательности и схожие химические реакции с другими группами элементов в таблице.
Изучение свойств галогенов внутри группы и их взаимодействия с другими элементами помогает нам лучше понять их роль в химических процессах, а также расширяет наши знания о взаимодействии различных элементов в периодической системе.
Вопрос-ответ

Для чего нужно знать расположение галогенов в периодической таблице?
Знание расположения галогенов в периодической таблице позволяет понять их химические свойства, взаимодействия с другими элементами и применение в различных сферах.
Какие элементы относятся к галогенам?
К галогенам относятся фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At).
Почему галогены расположены именно в седьмой группе периодической таблицы?
Галогены расположены в седьмой группе периодической таблицы, потому что они обладают семью валентными электронами во внешней электронной оболочке.
Какие свойства характерны для галогенов?
Галогены обладают высокой электроотрицательностью, высокой активностью и являются сильными окислителями. Они также образуют химические соединения с множеством элементов.
Каково применение галогенов в практических целях?
Галогены широко используются в различных областях, включая производство химических соединений, промышленность, медицину, освещение и другие. Например, хлор используется для очистки воды, а йод – в производстве лекарственных препаратов.