Химические растворы – незаменимый элемент в широком спектре химических исследований и промышленных процессов. Однако, проследить становление смеси из различных веществ – это искусство, требующее мастерства и глубокого понимания химических свойств соединений. Приготовление раствора – это процесс, важная составляющая которого – пошаговое определение точного количества вещества, которое требуется для достижения определенных результатов. В этой статье мы рассмотрим основные понятия, которые лежат в основе процесса приготовления растворов и приведем примеры, иллюстрирующие их реальное применение.
Прекрасность приготовления растворов заключается в точном расчете количества и соотношения реагентов, чтобы достичь желаемых результатов эксперимента или процесса. Чаще всего, это требует аккуратности и тщательности в измерении и смешивании ингредиентов, так как даже незначительное отклонение от расчетов может привести к неудовлетворительным или непредсказуемым результатам. Успешное приготовление раствора требует использования точных методов измерения и внимания к каждому нюансу, чтобы обеспечить консистентность и повторяемость эксперимента или процесса.
Приготовление раствора - это более чем просто смешивание веществ. Это процесс, включающий в себя рассмотрение молекулярных связей, растворимости, реакций и энергии. Мастерство в проведении растворов, получаемое через понимание этих концепций, является неотъемлемой частью работы химика и способствует достижению превосходных результатов.
Основные принципы разработки растворов в химической области
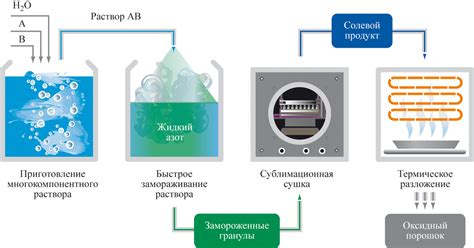
Наука химии активно использует процесс приготовления растворов для достижения определенных результатов. Это важное понятие в химии, которое имеет применение как в лабораторных условиях, так и в индустриальных процессах. Ключевая идея в определении приготовления растворов заключается в том, что вещество, называемое растворителем, полностью смешивается с другим веществом, называемым растворяемым веществом, образуя однородное смешение. Приготовление растворов осуществляется в соответствии с определенными принципами и правилами, которые позволяют достичь желаемого состава и свойств раствора.
Для успешного приготовления растворов важно учитывать концентрацию и соотношение компонентов, выбирать подходящий метод смешивания, контролировать температурные условия и другие важные параметры. Процесс приготовления растворов может быть достаточно простым, например, смешивание порошка в воде, или требовать сложных процедур и ступеней, таких как действие сильных кислот или щелочей.
- Концентрация раствора: определяет количество растворимого вещества, содержащегося в единице объема раствора;
- Растворимость: свойство растворимого вещества взаимодействовать с определенным растворителем и образовывать раствор;
- Состав раствора: определяет тип и соотношение компонентов, составляющих раствор;
- Температурные условия: влияют на скорость растворения и физические свойства раствора;
- Метод смешивания: определяет способ, с помощью которого проводится процесс смешивания компонентов.
Процесс приготовления растворов является важной составляющей работы химиков и научных исследований. Он позволяет изучать свойства и взаимодействия веществ, создавать новые материалы и применять их в различных сферах науки и промышленности. Понимание основных понятий и принципов, связанных с приготовлением растворов, является важным для успешного проведения химических экспериментов и достижения конкретных результатов.
Состав и свойства растворов

Основные компоненты, входящие в состав растворов, определяют их свойства и способность растворяться. Составляющие растворы могут быть различными веществами, такими как соли, кислоты, щелочи, газы и многие другие.
В зависимости от химической природы веществ, содержащихся в растворах, можно выделить несколько основных типов:
| Тип раствора | Примеры составляющих веществ |
|---|---|
| Соляные растворы | Хлорид натрия (NaCl), хлорид калия (KCl) |
| Кислотные растворы | Соляная кислота (HCl), серная кислота (H2SO4) |
| Щелочные растворы | Гидроксид натрия (NaOH), гидроксид калия (KOH) |
| Газовые растворы | Кислород (O2) в воде, углекислый газ (CO2) в воде |
Каждый из этих типов растворов имеет свои особенности и характерные свойства, включая температурную зависимость, концентрацию, pH-значение и др. Понимание состава растворов позволяет проводить более точные расчеты и прогнозировать их поведение в различных условиях.
Растворимость веществ
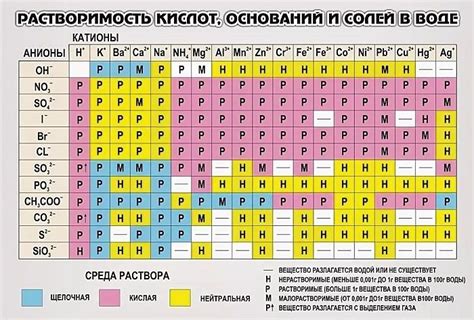
В разделе "Растворимость веществ" мы разберем основные понятия и явления, связанные с способностью веществ растворяться в различных растворителях.
Растворимость - это свойство вещества взаимодействовать с другими веществами в такой мере, что оно может равномерно раствориться в растворителе. При этом, в процессе растворения, молекулы или ионы вещества распадаются на частицы, которые диспергируются в растворе. Одни вещества легко растворяются и образуют насыщенные растворы, другие же проявляют низкую растворимость и требуют известных условий для полного растворения.
Растворимость вещества в значительной степени зависит от природы самого вещества и характера используемого растворителя. Некоторые вещества образуют растворы в воде, другие - в органических растворителях, а есть также вещества, которые могут растворяться в обоих типах растворителей. Существуют различные факторы, влияющие на растворимость вещества, такие как температура, давление, концентрация и присутствие других веществ в растворе.
- Примеры веществ, образующих высокорастворимые растворы в воде: соль, сахар, кислоты;
- Примеры веществ, образующих низкорастворимые растворы в воде: серебро, глина, железо;
- Примеры веществ, растворимых и в воде, и в органических растворителях: спирт, эфир, глицерин.
Изучение растворимости веществ позволяет более точно понимать процессы химических реакций и узнавать, как вещества будут взаимодействовать друг с другом в конкретных условиях. Знание растворимости позволяет контролировать и управлять процессами разделения и смешения веществ, что имеет важное практическое значение для многих областей химии и других наук.
Концентрация раствора

Концентрация раствора является ключевым показателем при проведении экспериментов и решении химических задач. Она позволяет определить, насколько насыщенным является раствор, и даёт возможность контролировать количество добавляемого вещества. Например, при подготовке медицинских растворов очень важно правильно определить и проверить их концентрацию, чтобы гарантировать безопасность и эффективность их использования.
Важно отметить, что концентрация раствора может изменяться в процессе приготовления или хранения. Это может произойти в результате добавления или удаления вещества, испарения растворителя или других физических и химических процессов. Умение правильно рассчитать и управлять концентрацией раствора является важным навыком для химиков, фармацевтов и других специалистов, работающих с растворами.
Расчёт объёма и массы растворителя

Определение объёма растворителя важно для того, чтобы подобрать подходящий реагент и установить необходимое соотношение между растворителем и растворенным веществом. Расчёт массы растворителя особенно важен при работе с веществами, где массовая концентрация имеет значение.
- Определение объёма растворителя выполняется с помощью градуированной пробирки, мерной колбы или цилиндра. Необходимо учитывать показания шкалы, а также учитывать объём других компонентов раствора.
- Расчёт массы растворителя проводится исходя из необходимой концентрации раствора и её зависимости от массы растворенного вещества. Для этого используются формулы и уравнения, основанные на данный момент знаниях о химических свойствах растворителя и растворённого вещества.
Для достижения точности и надёжности расчётов объёма и массы растворителя необходимо уметь использовать правильные методы измерений и анализа данных. Тщательное выполнение этих шагов является неотъемлемой частью химического эксперимента и добытой информации может быть использовано при дальнейших исследованиях.
Вопрос-ответ

Что такое раствор в химии?
Раствор в химии - это гомогенная смесь, состоящая из двух или более веществ: растворителя и растворенного вещества. В растворе растворенное вещество равномерно распределено в растворителе.
Какой метод используется для приготовления раствора в химии?
Одним из основных методов приготовления растворов в химии является метод взвешивания и сливания. При этом методе измеряется необходимое количество растворенного вещества, которое взвешивается на аналитических весах и затем растворяется в растворителе. Затем полученный раствор смешивается путем сливания вещества в растворитель и перемешивания.
Какой прибор используется для приготовления раствора в химии?
Для приготовления раствора в химии чаще всего используются мерные колбы. Мерная колба - это стеклянный сосуд с узким горлом и постоянным объемом. Она позволяет точно измерить и смешать определенное количество растворенного вещества с растворителем.
Какие факторы могут влиять на приготовление раствора?
При приготовлении раствора в химии могут влиять различные факторы, такие как температура и концентрация раствора. Температура растворителя может влиять на скорость растворения растворенного вещества. Концентрация раствора определяется количеством растворенного вещества, добавленного в определенный объем растворителя, и также может оказывать влияние на процесс приготовления раствора.
Какие есть примеры приготовления растворов в химии?
Примеры приготовления растворов в химии включают растворение соли в воде, приготовление кислотных или щелочных растворов, приготовление растворов с переизбытком растворенного вещества и другие. Например, при приготовлении раствора соли в воде, определенное количество соли взвешивается и растворяется в определенном объеме воды.
Как определить приготовление раствора в химии?
Приготовление раствора в химии - это процесс, в результате которого вещество (растворимое вещество) полностью или частично растворяется в растворителе. Для определения приготовления раствора необходимо учитывать массу и концентрацию вещества, объем растворителя, а также процентное содержание растворимого вещества.



