Раскрытие и изучение закономерностей природы - это огромная задача, определяющая развитие наших знаний о мире, в котором мы живем.
Научные исследования в области химии имеют серьезное значение для нашего понимания о веществах и их свойствах. Однако есть такие аспекты, которые заслуживают особого внимания - и одним из них является молекулярная масса.
Молекулярная масса играет важную роль в системе Менделеева, которая является основой современной химии. Она помогает определить состав и химические свойства вещества, а также является основой для создания уравнений химических реакций и предсказаний о свойствах различных соединений.
Таким образом, понимание положения молекулярной массы в системе Менделеева является необходимым для всех, кто интересуется химией или стремится расширить свои знания о мире химических элементов.
Чтобы полностью охватить этот аспект, необходимо изучить историю развития и использования молекулярной массы в научных исследованиях. В этой статье мы рассмотрим исторические моменты, а также предоставим интересные факты и справочную информацию, которая поможет вам лучше понять роль молекулярной массы в таблице Менделеева.
Истоки открытия и исследования химической массы

Этот раздел посвящен истории возникновения и развития понятия о химической массе. Мы рассмотрим первые шаги ученых, их открытия и основные вехи исследовательской работы. Вернемся к самым древним временам, когда идеи о составе и свойствах веществ еще только начинали формироваться. Исследования в этой области были тесно связаны с различными отраслями естествознания, начиная от философии и заканчивая физикой и химией.
Первые истоки изучения химической массы можно проследить до древних греков, которые стремились понять природу материи и ее составные элементы. Они производили опыты и наблюдали за химическими реакциями, однако наукой в современном понимании тогда еще не считалось. Постепенно, с развитием алхимии в средневековье, ученые начали изучать свойства и состав веществ, проводя сложные эксперименты и разрабатывая техники измерения массы.
Существенный прогресс в изучении химической массы произошел в XVIII веке, когда ученые стали сознавать, что каждое вещество имеет свою уникальную массу. Они разработали первые методы и приборы для определения массы элементов и соединений, основываясь на наблюдениях за химическими реакциями. Постепенно накапливаемые данные и результаты измерений позволили ученым разработать систематический подход к классификации химических элементов и связать массу вещества с его свойствами.
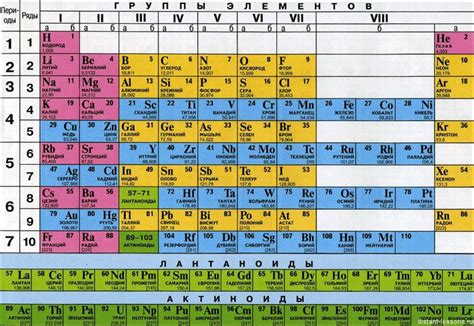
В конце XIX века, с появлением таблицы Менделеева, химические элементы были упорядочены по возрастанию атомной массы, что придало им систематичность и позволило ученым предсказывать свойства новых открытий. Однако молекулярная масса в таблице Менделеева не была учтена, так как она связана с массой молекулы вещества. Понятию молекулярной массы уделяли все больше внимания в научных исследованиях XX века, что привело к его выделению и значимости в современной химии.
Масса атома: ключевой указатель химических свойств элементов
Масса атома, являющаяся важной характеристикой химических элементов, устанавливает их свойства и роль в химических реакциях. Величина этого показателя определяет, какие соединения элемент может образовывать и как взаимодействует с другими веществами.
Показатель массы атома, который широко использовался в истории химии, был существенным в формировании таблицы Менделеева и классификации элементов. С его помощью была выявлена периодическая зависимость химических свойств элементов и разработана систематическая сетка, базирующаяся на атомных массах.
Масса атома позволяет определить, как именно атомы элемента взаимодействуют между собой, образуя структуру и связи в соединениях, а также устанавливает их относительные пропорции. Это величина играет ключевую роль в формировании физико-химических свойств веществ, включая молекулярную массу, плотность, температуру плавления и кипения.
Постулаты Авогадро и Дальтона: ключевые принципы, являющиеся фундаментом химической науки

В данном разделе мы рассмотрим два важных постулата, сформулированных Авогадро и Дальтоном, которые оказали огромное влияние на развитие химии и стали основой молекулярно-кинетической теории вещества.
Первый постулат, предложенный Авогадро в начале XIX века, заключается в том, что равное объему газа содержит одинаковое число молекул. Этот принцип стал краеугольным камнем в понимании молекулярной структуры веществ и позволил объяснить множество химических явлений на молекулярном уровне.
Следующим важным принципом является постулат Дальтона, сформулированный в том же времени. Он утверждал, что все вещества состоят из неделимых и непроницаемых частиц, названных атомами. Таким образом, Дальтон показал, что различные элементы обладают разными атомными массами и могут соединяться в определенных пропорциях, образуя соединения.
Эти два постулата оказались революционными для химической науки, поскольку они предоставили ключевые концепции и инструменты для понимания молекулярной структуры веществ, расчета и понимания соединительной способности элементов. Они легли в основу современной таблицы Менделеева и сформировали базу для развития химического знания и технологий на протяжении последующих веков.
Раннее определение характеристик молекул: первые измерения и идеи развития

В зачаточной стадии исследований химических процессов, учеными мира широко размышлялось о природе и составе молекул. Они интуитивно осознавали, что молекулярная масса играет важную роль в понимании свойств химических веществ и их реакций. Не имея доступа к современным методам измерений и технологиям, первые исследователи опирались на наблюдения и дедуктивное мышление, чтобы выявить и визуализировать характеристики молекул, а также предложить основы для ее измерения.
Первые измерения молекулярной массы представляли собой попытку определить количественные значения, связанные с массой молекулы и ее удельной массой. Ученые проводили наблюдения, эксперименты и анализировали полученные данные, чтобы понять закономерности и установить связи. Идеи развития в этой области появлялись постепенно, с последующими усовершенствованиями методов и развитием современной техники.
| Исследователь | Первое измерение | Результаты |
|---|---|---|
| Авогадро | Определение относительных молекулярных масс путем измерения плотности и объема газовых смесей | Установил закон Авогадро (равные объемы газов при одинаковой температуре и давлении содержат одинаковое число молекул) |
| Dalton | Пропорциональность между атомными и молекулярными массами через определение массовых соотношений в реакциях | Предложил теорию атомов и в основу его системы дал теорию замещения |
| Gay-Lussac | Определение соотношения между объемами газовых реагентов | Сформулировал закон пропорций по объемам (объемы газовых реагентов и образовавшихся газов в простых химических реакциях имеют простые, целочисленные соотношения) |
Таким образом, первые измерения молекулярной массы имели важное значение в истории науки, поскольку они предоставили основу для развития теоретических и экспериментальных подходов к изучению химических соединений, а также частично подготовили почву для создания таблицы Менделеева, в которой впоследствии были указаны молекулярные массы, атомные массы и другие характеристики химических элементов и соединений.
Эволюция методов исследования

Развитие научных методов, применяемых для изучения химических свойств веществ, играет ключевую роль в определении химической композиции молекул. Исторически сложившиеся методы постепенно эволюционировали, от простых и грубых до более точных и современных подходов.
В истории химии были разработаны различные методики для определения молекулярной массы вещества, которые использовались до появления таблицы Менделеева. Одним из первых методов был метод газовой плотности, основанный на измерении плотности газа и его относительной массы. Позднее были разработаны методы, основанные на анализе парниковых газов и определении процента составляющих веществ в смесях.
С развитием научных технологий и появлением современных приборов возникла возможность применять более точные методы исследования. Один из таких методов – газовая хроматография, которая позволяет разделить смесь на компоненты и определить их концентрацию. Этот метод также находит применение при исследовании молекулярной массы вещества.
С приходом электронной микроскопии развился метод масс-спектрометрии, позволяющий определить молекулярную массу вещества путем ионизации его молекул и исследования их массового спектра. Этот метод является одним из самых точных и позволяет определить молекулярную массу с высокой точностью.
Современная химия продолжает разрабатывать новые методы исследования, обеспечивая все более точную и надежную информацию о молекулярной массе вещества. Применение различных методик исследования является неотъемлемой частью химических исследований и позволяет более глубоко понять и описать свойства и структуру различных веществ.
Чем определяется значение молекулярной массы и почему это понятие важно?

В химии существует понятие молекулярной массы, которое играет ключевую роль в понимании физических и химических свойств веществ. Молекулярная масса определяется количеством атомов в молекуле и их относительными массами. Знание молекулярной массы помогает ученым понять связи между структурой вещества и его свойствами, а также прогнозировать его поведение в химических реакциях. Понимание значения молекулярной массы стало неотъемлемой частью химической науки и имеет важные практические применения в различных областях, включая медицину, фармакологию, пищевую промышленность и материаловедение.
Молекулярная масса является ключевой характеристикой вещества и может быть определена различными методами. Одним из основных методов является масс-спектрометрия, которая позволяет точно измерить массу молекулы путем анализа ее фрагментов. Другим распространенным методом является вычисление молекулярной массы на основе известных атомных масс элементов, из которых состоит молекула.
Значимость понятия молекулярной массы проявляется во многих аспектах химического исследования. По молекулярной массе можно определить состав вещества, его чистоту и степень окисления. Это необходимо для проведения точных экспериментов и получения конкретных результатов. Кроме того, знание молекулярной массы позволяет оптимизировать процессы синтеза и прогнозировать свойства новых соединений. Применение молекулярной массы расширяется на промышленность, где она используется для контроля качества продукции и разработки новых материалов с желаемыми свойствами.
- Молекулярная масса - ключевое понятие химии
- Определение молекулярной массы через масс-спектрометрию и вычисления
- Роль молекулярной массы в химическом исследовании и промышленности
Роль молекулярной массы в химических реакциях: основные принципы и влияние на процессы
Молекулярная масса играет ключевую роль в химических реакциях, несущих на себе ответственность за различные процессы в мире химии. Она представляет собой суммарную массу атомов, составляющих молекулу, и может иметь огромное влияние на динамическую природу взаимодействий химических веществ.
Молекулярная масса оказывает воздействие на все стороны химической реакции, начиная от скорости процесса и продуктов реакции, и заканчивая исследованиями в областях физической химии и биохимии. Она является важным фактором для определения количества веществ, необходимых для достижения определенного эффекта, а также для расчета выхода продуктов реакции.
Одной из ключевых концепций, связанных с молекулярной массой, является стехиометрия, которая изучает количественные отношения между веществами в химической реакции. Молекулярная масса позволяет точно определить соотношение между реагентами и продуктами реакции, а также содержание элементов в соединениях.
Существуют различные методы измерения молекулярной массы, включая гравиметрический анализ, масс-спектрометрию и хроматографию. Информация о молекулярной массе используется для проведения различных экспериментов и исследований, а также для разработки новых лекарственных препаратов, материалов и технологий.
Роль молекулярной массы в физических свойствах веществ
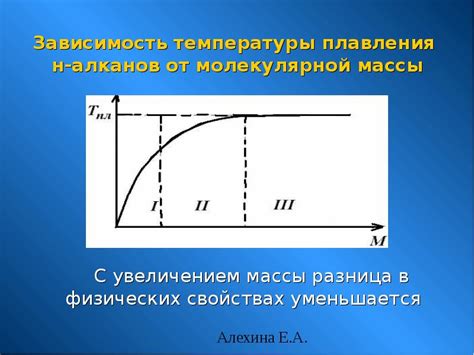
Наличие различной молекулярной массы у веществ обуславливает их отличительные свойства, такие как температура плавления и кипения, плотность, летучесть и другие. Вещества с меньшей молекулярной массой, как правило, обладают более низкой температурой плавления и кипения, а также более высокой летучестью. В свою очередь, вещества с большей молекулярной массой имеют более высокую плотность и более высокие точки плавления и кипения.
- Молекулярная масса отражает состав вещества и его структурные особенности. Например, полимеры с большой молекулярной массой образуют длинные цепочки, что придает им уникальные свойства, такие как гибкость или прочность.
- Молекулярная масса также влияет на растворимость вещества в различных растворителях. Вещества с низкой молекулярной массой обычно легко растворяются в различных растворителях, в то время как вещества с высокой молекулярной массой могут быть менее растворимыми или вовсе не растворяться.
- Молекулярная масса играет важную роль в процессах физической и химической реакций. Некоторые реакции между веществами могут быть специфическими и происходить только с определенными молекулами веществ с определенной молекулярной массой.
Таким образом, молекулярная масса играет не только роль индикатора химического состава и структуры вещества, но и существенно влияет на его физические свойства, определяя их уникальные характеристики и поведение в различных условиях.
Взаимосвязь между взаимодействиями молекул и их молекулярной массой

Молекулярная масса, один из важных показателей химических соединений, играет существенную роль в их взаимодействиях. Взаимосвязь между молекулярной массой и взаимодействиями молекул определяет химические свойства вещества и его поведение в различных условиях.
С увеличением молекулярной массы вещества обычно возрастает его инертность, что может сказаться на скорости реакций и способе взаимодействия с другими веществами. Более массивные молекулы обладают большей инерцией и тяжелее поддаются воздействию внешних факторов, таких как теплота или давление.
Кроме того, молекулярная масса вещества может влиять на его фазовые переходы и растворимость. Например, при повышении молекулярной массы полимеров уменьшается их склонность к растворению в воде или других растворителях. Это связано с трудностью проникновения растворителя в более крупные и сложные структуры полимерных цепей.
Также можно отметить, что взаимодействие молекул с меньшей молекулярной массой может проявляться с большей интенсивностью и энергией. Это может быть связано с более высокой подвижностью и активностью молекул малых размеров, которые могут эффективнее взаимодействовать с другими молекулами через химические связи или слабые силы притяжения.
- Взаимосвязь между молекулярной массой и активностью взаимодействий
- Влияние молекулярной массы на растворимость вещества
- Молекулярная масса и скорость химических реакций
- Взаимодействия молекул разной молекулярной массы в различных условиях
Помимо перечисленных факторов, взаимосвязь между молекулярной массой и взаимодействиями молекул может также иметь значение в областях, связанных с материаловедением, биохимией и фармакологией. Дальнейшие исследования в этой области позволят более глубоко понять взаимосвязь между молекулярной массой и химическими свойствами вещества, а также разработать новые материалы с оптимальными свойствами для различных применений.
Вопрос-ответ

Каково положение молекулярной массы в таблице Менделеева?
Молекулярная масса не является непосредственной характеристикой элемента и не имеет отдельной позиции в таблице Менделеева. Она представляет собой сумму атомных масс всех атомов в молекуле соответствующего вещества.
Почему молекулярная масса не включена в таблицу Менделеева?
Молекулярная масса не включена в таблицу Менделеева, потому что таблица Менделеева основана на атомных массах элементов, а не на молекулярных массах соединений. Кроме того, молекулярная масса является зависимой величиной, которая может изменяться в зависимости от соединения и его структуры.
Как определить молекулярную массу вещества?
Молекулярную массу вещества можно определить путем сложения атомных масс атомов, составляющих молекулу вещества. Для этого необходимо знать химическую формулу вещества и массы атомов, чтобы вычислить общую сумму атомных масс.
Что такое молярная масса и в чем ее отличие от молекулярной массы?
Молярная масса - это масса одного моля вещества, выраженная в граммах. Она представляет собой отношение молекулярной массы вещества к числу молей вещества. Молярная масса выражается в единицах г/моль, в то время как молекулярная масса измеряется в атомных единицах.
Какие исторические факты связаны с развитием представления о молекулярной массе в таблице Менделеева?
История развития представления о молекулярной массе в таблице Менделеева тесно связана с историей открытия и исследования элементов и соединений. Одним из важных этапов было открытие атомной теории, которая позволила понять, что вещества состоят из атомов, обладающих массой. В дальнейшем, при развитии химической науки, был установлен метод для вычисления молекулярных масс веществ и систематизировано их расположение в таблице Менделеева в соответствии с атомными массами.