В мире, где все стремительно преображается, идеальный газ остается одной из самых загадочных сущностей, кричащей о своей возможной метаморфозе. Виртуозность его превращения в состояние, где соблюдаются все условия реальности, разжигает пламя воображения, погружая нас в мир фантазий и догадок. Что было бы, если газ не просто оставался идеальным, а открывал вход в другое измерение, где правила реальности превращали его в нечто большее?
Путешествие в мир газообразных веществ несомненно богато на неожиданности. Его трансформация может быть сравнима с метаморфозой личности, поэтому стоит рассмотреть возможность, что она может выйти за пределы понятий "идеальности" и "состояния". А что, если газ способен ликвидировать границы между абстракцией и реальностью, превращаясь в поток энергии или привидение, где его молекулы тают, словно капли росы в зеленых лугах?
Сложно не увлечься идеей о газе, который вступает в союз с реальностью, осуществляя своего рода философское превращение. Это может быть грандиозная мечта ученых, испытывающих постоянную тягу к исследованию необъяснимого. Возможно, пределом его преобразования является лишь наше воображение, которое может спровоцировать развитие научной мысли и привести нас к новым открытиям, переворачивающим наше понимание мира.
Особенности уникального газового состояния

В данном разделе мы рассмотрим ключевые характеристики особого состояния вещества, которое известно как идеальный газ. Без углубления в конкретные термины и определения, мы попытаемся донести общую идею об этом феномене и описать его важные свойства.
- Безмассовость: в отличие от материальных объектов, идеальный газ не обладает массой, что делает его особенным и привлекательным объектом для исследования.
- Полная эластичность: при воздействии на него внешних факторов, идеальный газ способен мгновенно изменять свой объем и давление без потери энергии.
- Безвязность молекул: молекулы идеального газа движутся хаотически и независимо друг от друга, не образуя структурных связей или сил притяжения.
- Постоянство температуры: при заданном объеме идеальный газ подчиняется закону Бойля-Мариотта и его температура остается постоянной во время сжатия и расширения.
- Идеальная газовая константа: идеальный газ обладает уникальной газовой постоянной, которая остается постоянной для каждого конкретного газа независимо от его состояния.
В целом, идеальный газ представляет собой абстрактный концепт, который помогает упростить и моделировать поведение газовых смесей и веществ. Несмотря на свою абстрактность, идеальный газ играет важную роль в научных исследованиях и находит применение в различных отраслях, от физики и химии до аэродинамики и техники.
Основные отличия идеального газа от реального

Отличие между идеальным и реальным газом заключается в их поведении при различных условиях и наличии факторов, влияющих на молекулярное взаимодействие. Вследствие этого, идеальный газ следует модели совершенно другого типа, не учитывая дисперсию и размеры молекул, их слабое взаимодействие и изменение объема в условиях высокого давления.
Одним из главных отличий реального газа от идеального является наличие эффекта взаимного притяжения или отталкивания между молекулами. Это приводит к возникновению внутренних сил, которые способствуют изменению объема и давления газа, чему неучет в модели идеального газа. Кроме того, молекулы реального газа имеют конечные размеры, что накладывает ограничения на взаимное расположение и движение молекул.
Также, стоит отметить, что различия между идеальным газом и реальным проявляются при изменении параметров, таких как давление, температура и объем. При высоких давлениях и низких температурах, а также при сжатии газа, реальные свойства газа становятся значительно отличаться от идеальных. В идеальном газе же, изменение этих параметров не оказывает существенного влияния на его поведение.
Физические законы, описывающие поведение идеального газа
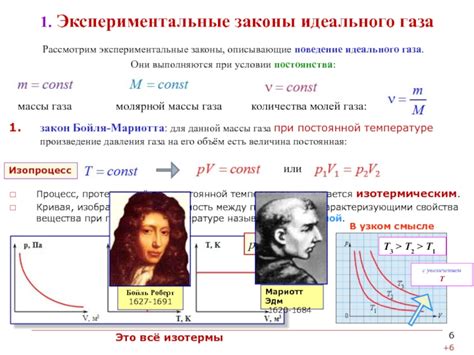
В данном разделе рассмотрим основные физические законы, которые позволяют описать поведение идеального газа. Выясним, какие принципы лежат в основе его функционирования и каким образом можно математически описать его параметры и свойства.
- Закон Бойля-Мариотта
- Закон Шарля
- Закон Гей-Люссака
- Уравнение состояния идеального газа
Первый закон, который требует нашего внимания, - это закон Бойля-Мариотта. Он устанавливает, что при постоянной температуре объем идеального газа обратно пропорционален его давлению. Таким образом, при увеличении давления объем газа уменьшается, а при уменьшении давления объем увеличивается.
Второй закон, изучаемый в этом разделе, - закон Шарля. Согласно ему, при постоянном давлении объем идеального газа прямо пропорционален его температуре. Из этого закона вытекает, что при нагревании газа он расширяется, а при охлаждении сжимается.
Третий закон, который мы рассмотрим, - это закон Гей-Люссака. Согласно ему, при постоянном объеме температура идеального газа прямо пропорциональна его давлению. Это означает, что при увеличении давления газа его температура также увеличивается и наоборот.
В конечном счете, для полного описания поведения идеального газа, мы должны упомянуть уравнение состояния. Например, идеальный газ можно описать с помощью уравнения Менделеева-Клайперона, которое устанавливает связь между давлением, объемом, температурой и количеством вещества газа. Это уравнение играет ключевую роль в термодинамике и позволяет предсказать поведение идеального газа при различных условиях.
Осуществление идеальных условий для газа: фантазия или достижимая реальность?

Фантастический идеал отсутствия давления, сил притяжения между молекулами и межмолекулярного взаимодействия, воплощается в понятии идеального газа. Но насколько это возможно в реальности? Интерес к данной теме обусловлен не только осознанием ограничений самой природы взаимодействия молекул газа, но и практическими приложениями, такими как технологические процессы и высокоточные измерения.
- Возможно ли создание условий, при которых силы притяжения и межмолекулярного взаимодействия настолько незначительны, что газ приблизится к идеальности?
- Существуют ли технические методы и приспособления, которые позволят уменьшить влияние факторов, препятствующих газу стать идеальным?
- Какие преимущества и недостатки может иметь такое стремление к идеальности?
Эти и другие вопросы являются предметом дебатов и дискуссий в научном сообществе. С одной стороны, реализация идеальных условий может значительно упростить расчеты и моделирование процессов, связанных с газами. С другой стороны, создание таких условий может столкнуться с техническими и физическими ограничениями, а также вызвать необходимость в использовании больших ресурсов и энергии.
Ограничения перевода реального газа в видеальное состояние
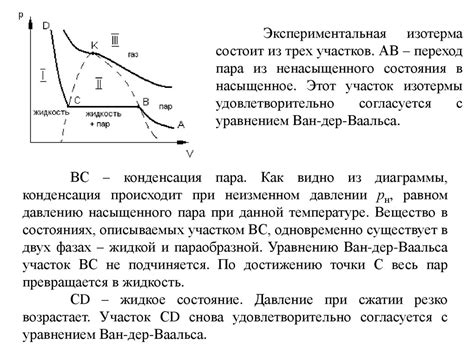
Одним из ограничений является нелинейность связи между давлением и объемом газа. В реальных условиях давление газа не всегда линейно зависит от его объема, что затрудняет достижение идеального состояния. Необходимы точные вычисления и учет нелинейности для достоверного моделирования реальных процессов.
Еще одним ограничением является пренебрежение взаимодействием между молекулами газа. В идеальном состоянии считается, что между молекулами газа нет взаимодействия, однако в реальной жизни это не всегда так. Интермолекулярные силы и взаимодействия влияют на свойства газа и оказывают значительное влияние на его поведение.
Также стоит отметить, что реальные газы могут содержать примеси или иметь неоднородную структуру, что также усложняет перевод в идеальное состояние. Эти факторы могут привести к нелинейным зависимостям между давлением, объемом и температурой газа, а также вызывать неожиданные изменения свойств газа при изменении экспериментальных условий.
Инженеры и ученые продолжают исследовать и разрабатывать методы и модели, которые позволят учитывать все эти ограничения и достичь максимальной близости реального газа к идеальному состоянию. Несмотря на сложности и ограничения, переход от реального газа к идеальному все еще является актуальной задачей, которая позволит более точно понимать и прогнозировать поведение газовых систем.
Практическое применение идеального газа в технологиях
В нашем современном мире идеальный газ играет неотъемлемую роль в различных технологических процессах. Он находит широкое применение во множестве отраслей промышленности и научных исследований, обеспечивая определенные преимущества и возможности, которые необходимы для развития современных технологий и удовлетворения наших потребностей.
Использование идеального газа в различных технологиях позволяет достичь точности и предсказуемости в процессах, связанных с поддержанием определенных условий, контролем давления и температуры, а также многими другими параметрами.
В промышленности идеальный газ находит применение в процессах сжатия и расширения, охлаждения и нагрева, управления движением и передачи энергии. Он широко используется в машиностроении, электронике, автомобильной промышленности и других отраслях, где точность и стабильность процессов являются основными требованиями.
Также идеальный газ может быть применен в научных исследованиях и лабораторных экспериментах, где его свойства и поведение могут быть точно изучены и использованы для получения новых знаний и научных открытий. Он позволяет создавать и анализировать различные модели и численные методы для описания и предсказания различных физических процессов и явлений.
Однако, несмотря на свою идеальность, газы в реальности не всегда соответствуют идеальной модели. Их поведение может быть изменено под влиянием различных факторов, таких как давление, температура, силы притяжения между молекулами и многие другие. Поэтому важно учитывать и адаптировать модели идеального газа для конкретных условий и задач.
Исследования на пути к созданию идеального газа

Исследователи проводят различные эксперименты и теоретические исследования, чтобы понять поведение различных газов при различных условиях. Они стараются выявить закономерности взаимодействия молекул в газовой среде и определить, какие условия могут приблизить газ к идеальному состоянию.
Одна из основных задач исследователей - выявление факторов, которые могут влиять на давление, объем и температуру идеального газа. Отклонения от идеального состояния могут возникать из-за межмолекулярных взаимодействий, ненулевых объемов молекул и других факторов, которые нужно учитывать при создании условий, приближенных к идеальным.
Одной из путей приближения к идеальному газу является снижение давления и увеличение объема газа. Подобные эксперименты позволяют уменьшить взаимодействия между молекулами и приблизить газ к предельной кинетической энергии идеального газа. Это может привести к уменьшению отклонений от идеальности.
Исследования на пути к созданию идеального газа включают и разработку новых методик, с использованием которых можно создавать условия, максимально близкие к идеальным. Кроме того, исследователи совершенствуют модели и теории, основанные на экспериментальных данных, чтобы получить более точное представление о поведении газов.
В целом, исследования по созданию идеального газа продолжаются, и хотя полная реализация этой цели кажется отдаленной, достижения на этом пути помогают нам лучше понять физические свойства газов и применять этот знания в различных областях науки и техники.
Влияние различных факторов на характеристики газа: температура, давление, объем
Температура - это мера средней кинетической энергии молекул газа. При изменении температуры меняется и скорость молекул, что приводит к изменению их силы столкновения. Таким образом, температура влияет на плотность и давление газа.
Давление - это сила, действующая на единицу площади. При увеличении давления газ становится более сжатым и его молекулы мгновенно сталкиваются друг с другом, вызывая увеличение скорости и интенсивности их движения.
Объем - это пространство, занимаемое газом. Изменение объема может происходить путем сжатия или расширения газа. Это воздействие напрямую связано с давлением и температурой, поскольку они влияют на межмолекулярные силы в газе.
Таким образом, взаимосвязь между температурой, давлением и объемом газа имеет существенное значение для определения его состояния и свойств. Исследование этой проблематики позволяет углубить наше понимание газовой теории и расширить знания о влиянии различных факторов на поведение газа в реальных условиях.
Вопрос-ответ

Что такое перевод идеального газа в состояние?
Перевод идеального газа в состояние - это процесс, в ходе которого идеальный газ превращается в состояние близкое к идеальному, где межмолекулярные взаимодействия не играют существенной роли. В таком состоянии газ полностью соответствует свойствам идеального газа.
На каких основаниях можно считать идеальные газы идеальными?
Идеальные газы являются упрощенными моделями реальных газов, которые обладают следующими свойствами: молекулы газа считаются материальными точками без объема и взаимодействуют только при столкновениях, межмолекулярные взаимодействия не учитываются, газ не испытывает внешних сил и находится в состоянии термодинамического равновесия.
Возможен ли перевод реального газа в состояние идеального?
В теории, перевод реального газа в состояние идеального газа невозможен, так как реальные газы всегда испытывают межмолекулярные взаимодействия и взаимодействуют с внешними силами. Однако, в определенных условиях, можно приблизить газ к идеальному состоянию, например, при очень низких давлениях и высоких температурах, когда межмолекулярные взаимодействия становятся несущественными.
Зачем нужен перевод газа в состояние идеального?
Перевод газа в состояние идеального может быть полезным в научных и инженерных расчетах, где необходимо упростить модель газа для более простого решения задач. Идеальный газ обладает простыми математическими свойствами, что позволяет упростить расчеты и получить более точные результаты в определенных случаях.



