Мы воспринимаем мир вокруг нас как что-то основанное на зримых и осязаемых предметах. Однако, если мы не берем во внимание невидимые компоненты, то упускаем одну из важных частей нашего существования. Невидимая, но существенная для понимания мира, является оболочка атома. Известная также как электронная оболочка, она выполняет важные функции, обеспечивая стабильность и связь атомов между собой. В этой статье мы рассмотрим принципы и основные компоненты, которые определяют структуру оболочки атома.
Оболочка атома может быть воспринята как "оболочка" или "оболочки", которые окружают атом и содержат электроны - элементарные частицы с отрицательным зарядом. Их распределение в оболочке, их количество и их взаимодействия являются ключевыми аспектами понимания поведения и свойств атомов и, соответственно, всего вещества.
Важно отметить, что оболочку атома можно представить как аналог многокомнатного дома, где каждая комната представляет собой различные энергетические уровни, на которых находятся электроны.
Структура атома: ключевые составляющие и принцип формирования электронной оболочки
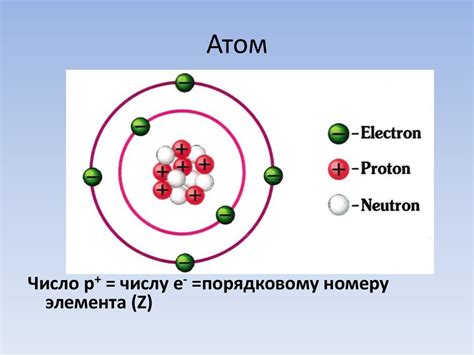
В данном разделе рассмотрим составляющие атома, которые определяют его структуру, и основной принцип формирования электронной оболочки.
Атом состоит из ядра, в котором находятся протоны и нейтроны, и окружающей данное ядро электронной оболочки. Ядро является центром атома и содержит большую часть его массы. Протоны, как частицы положительного заряда, находятся внутри ядра, в то время как нейтроны не имеют заряда.
Около ядра располагаются электроны, которые имеют отрицательный заряд. Они могут находиться на разных уровнях энергии, которые называются электронными оболочками. Количество электронных оболочек у атома определяется его номером в периодической системе.
Формирование электронной оболочки происходит по принципу заполнения энергетических уровней электронами. Более близкие к ядру оболочки имеют меньшую энергию и могут вмещать ограниченное количество электронов. Уровни дальше от ядра имеют большую энергию и могут вместить большее количество электронов.
Электроны заполняют энергетические уровни по правилам заполнения оболочек. Они распределяются вокруг ядра таким образом, чтобы оболочки были максимально заполнены и обладали наиболее низкой энергией.
Понимание структуры атома и принципов образования электронной оболочки является основой для изучения его физических и химических свойств, а также позволяет объяснить различные явления в микромире.
Электрон и ядро: ключевые компоненты строения атома
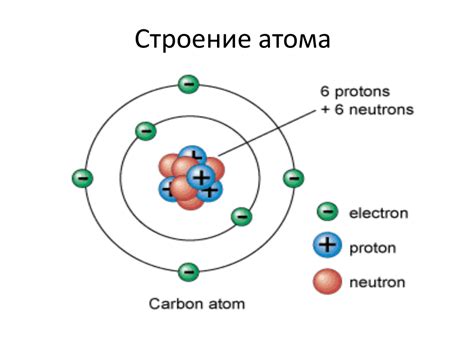
- Электрон: основной строительный блок атома
- Ядро: центральная часть атома
Электрон - отрицательно заряженная элементарная частица, которая обращается вокруг ядра и образует электронную оболочку атома. Взаимодействие электрона с ядром и другими электронами определяет различные физические и химические свойства вещества.
Ядро - положительно заряженная часть атома, расположенная в его центре. Оно состоит из протонов, имеющих положительный заряд, и нейтронов, не имеющих заряда. Ядро атома содержит большую часть его массы и определяет его химические свойства.
Взаимодействие электрона и ядра обуславливает формирование энергетических уровней, атомных орбиталей и химических связей. Разница в заряде между электроном и ядром приводит к электростатическому притяжению или отталкиванию, что влияет на структуру атома и его реакционную способность. Понимание роли электрона и ядра является фундаментальным для объяснения множества явлений и свойств в мире микрочастиц и химических взаимодействий.
Квантовые уровни оболочки атома: первоначальная организация электронных структур
1. Орбитали: В результате квантовых механических расчетов атомные энергетические уровни абстрагируются в качестве орбиталей. Они определяют области, в которых могут находиться электроны атома.
2. Квантовые числа: Для описания квантовых уровней используются особые числа – квантовые числа. Главное квантовое число определяет энергетические уровни, орбитальное квантовое число – форму орбитали.
- Главное квантовое число (n): Устанавливает основной энергетический уровень электрона в атоме. Чем больше значение этого числа, тем выше энергетический уровень.
- Орбитальное квантовое число (l): Определяет форму, размер и энергетическое положение орбитали.
- Магнитное квантовое число (m): Задает ориентацию орбитали в пространстве. Возможные значения зависят от значения орбитального квантового числа.
- Спиновое квантовое число (s): Характеризует величину и направление вращения электрона вокруг своей оси.
3. Энергетические уровни: При первоначальной организации атома электроны заполняют уровни с более низкой энергией. Принцип заполнения заряженных оболочек атома подчиняется правилу Клейн-Гордона и правилу Ауфбау.
4. Наполненность орбиталей: В каждой орбитали не может находиться более двух электронов. Принцип Паули гласит, что электроны в орбитали должны иметь противоположные спиновые квантовые числа.
Изучение первоначальной организации атома и его электронной оболочки с вызовом глубокого интереса исследователей и имеет важное значение в понимании физических свойств атомов и их взаимодействия.
Орбитали и подуровни: внутреннее устройство электронной оболочки

Орбитали представляют собой трехмерные области пространства, в которых вероятностная функция электрона достигает максимума. Рассмотрение орбиталей позволяет лучше понять, как электроны распределяются вокруг атомного ядра. Орбитали бывают различных форм и ориентаций, таких как s (сферические), p (двухлопастные), d (шестилопастные) и f (перепончатые).
Подуровни представляют собой совокупность орбиталей с одинаковым главным квантовым числом и различными моментами спина. Они указывают на энергетический уровень, на котором находятся электроны в атоме. Внутри одного подуровня орбитали имеют различную форму и ориентацию, но с одинаковой энергией. Подуровни обозначаются символами s, p, d, f и соответствуют главным квантовым числам 1, 2, 3, 4 соответственно.
Понимание орбиталей и подуровней позволяет провести анализ электронной оболочки атома и лучше понять его химические свойства. Знание внутренней структуры атома также является основой для построения периодической системы элементов и объяснения различных явлений в химии и физике. Разбиение электронных орбиталей на подуровни является удобной системой классификации, которая помогает описать химические и физические свойства атомов и их соединений.
Распределение электронов по оболочкам: определение энергетических уровней
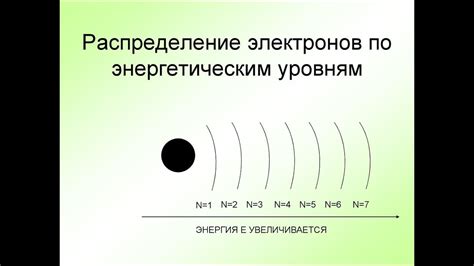
В данном разделе мы рассмотрим процесс распределения электронов в атоме, а именно определение энергетических уровней, на которых они находятся. Каждый атом обладает определенными энергетическими состояниями, которые определяют, какие оболочки будут заняты электронами.
Наиболее близкие к ядру оболочки имеют наименьшую энергию и содержат меньшее количество электронов. Постепенно, с увеличением расстояния от ядра, энергия оболочек возрастает, а максимальное количество электронов, которое могут содержать эти оболочки, увеличивается.
Атомы стремятся достичь наиболее устойчивого состояния, заполняя свои оболочки по принципу минимальной энергии. Это означает, что электроны предпочитают занимать оболочки с наименьшей энергией, прежде чем переходить на оболочки с более высокой энергией.
Распределение электронов по энергетическим уровням происходит согласно правилу Клейна-Гордона, которое определяет последовательность заполнения оболочек. Оно гласит, что на каждом энергетическом уровне должно находиться максимальное количество электронов, прежде чем энергетически более высокий уровень будет заполняться.
Для удобства распределения электронов по оболочкам введены энергетические подуровни, которые обозначаются латинскими буквами s, p, d, f. Каждый из подуровней может содержать разное количество электронов. Например, уровень s может содержать не более 2-х электронов, p - не более 6, d - не более 10, а f - не более 14.
Таким образом, понимание распределения электронов по оболочкам и определение их энергетических уровней является важной составляющей изучения структуры атомов и их химических свойств.
Вопрос-ответ

Какая роль играет электронная оболочка в строении атома?
Электронная оболочка является внешней частью атома и состоит из электронов, которые движутся вокруг ядра. Она определяет химические свойства атома и его взаимодействия с другими атомами.
Какие принципы определяют структуру электронной оболочки атома?
Структура электронной оболочки атома определяется несколькими принципами. Во-первых, электроны распределяются по энергетическим уровням, которые имеют определенную энергию. Во-вторых, принцип заполнения оболочек гласит, что электроны в атоме заполняют оболочки по возрастанию их энергии. И, в-третьих, принцип неполной оболочки гласит, что электроны заполняют оболочки таким образом, чтобы обеспечить максимальную стабильность атома.
Какова общая структура электронной оболочки атома?
Электронная оболочка атома состоит из нескольких энергетических уровней, на которых находятся электроны. Самый близкий к ядру уровень называется K-уровнем, затем идут L-, M-, N- и последующие уровни. Каждый уровень имеет определенное количество подуровней, на которых могут находиться электроны.
Каково количество электронов на каждом уровне электронной оболочки атома?
Количество электронов на каждом уровне электронной оболочки атома зависит от его атомного номера. Например, на K-уровне может находиться максимум 2 электрона, на L-уровне - до 8 электронов, на M-уровне - до 18 электронов и так далее. Количество электронов на каждом уровне определяется правилами заполнения оболочек и может быть рассчитано по таблице Менделеева.



