Химическое строение вещества – это невидимый мир, который заложен в основе всех химических реакций и процессов. Это сложная система взаимосвязанных элементов, атомов и связей между ними, которая придает веществу его уникальные свойства и характеристики.
Открытие теории химического строения стало настоящим прорывом в понимании природы и состава вещества. Эта теория позволила установить, что все вещества состоят из элементов, которые присутствуют в виде отдельных атомов или молекул, объединенных в определенные структуры. Именно эти структуры определяют свойства и возможности каждого вещества.
Изучение теории химического строения позволяет понять, какие связи устанавливаются между атомами вещества, как они влияют на его устойчивость, реакционную способность и физические свойства. Это знание является основой для построения прогнозов о поведении вещества в различных условиях и позволяет разрабатывать новые вещества с заданными свойствами.
Таким образом, знание теории химического строения является ключевым фактором не только в химической науке, но и в многих других областях, таких как фармакология, материаловедение и промышленная химия. Понимание, как устроены вещества и как они взаимодействуют, открывает широкие горизонты для развития новых технологий и научных открытий, которые приводят к просто невероятным результатам.
Основные концепции структуры в химии
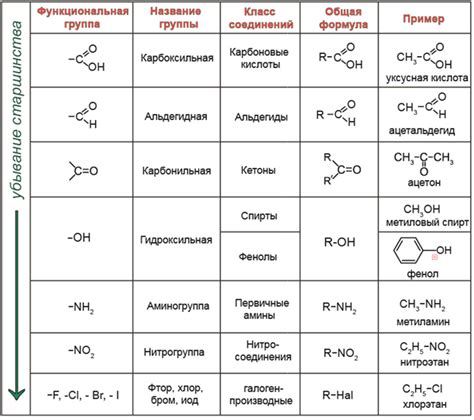
В этом разделе рассматриваются фундаментальные понятия, играющие важную роль в понимании химического строения веществ.
Конформация - это трехмерное пространственное расположение атомов в молекуле или ионе, которое определяет его свойства и возможности взаимодействия с другими частицами.
Периодичность - это закономерность изменения химических и физических свойств элементов в таблице Менделеева в зависимости от их атомного номера.
Межмолекулярные взаимодействия - это силы, действующие между различными молекулами и влияющие на их агрегатное состояние, свойства и реакционную способность.
Ионная связь - это тип химической связи, возникающей между положительно и отрицательно заряженными ионами.
Ковалентная связь - это тип химической связи, основанный на общем использовании электронных пар атомами, что приводит к образованию молекул и ионов.
Межмолекулярные силы - это слабые электростатические взаимодействия между молекулами, ответственные за вязкость жидкостей, теплоту парообразования и другие свойства.
Изучение этих основных понятий позволяет строить модели и предсказывать химические свойства и реактивность веществ, что имеет большое значение для различных областей науки и технологии.
Атом и его организация в химическом составе вещества
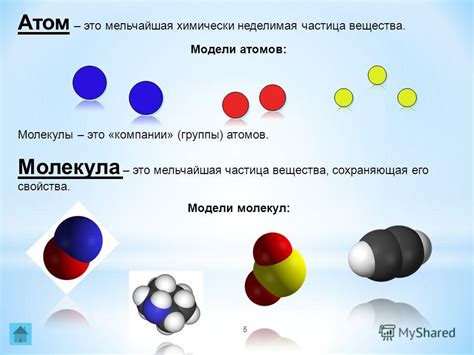
Основной элементарной единицей в мире химии является атом. Атом состоит из ядра, которое содержит протоны и нейтроны, и облака электронов, которое окружает ядро. Положение электронов в облаке определяет электронную структуру атома и его химические свойства.
Атомы различных элементов отличаются по числу протонов в их ядре, что определяет их атомный номер. Этот параметр также определяет химическое свойство элемента и его положение в периодической таблице.
Понимание структуры атома позволяет объяснить различные явления и реакции, которые происходят на молекулярном уровне. Знание атомной структуры и взаимодействия между атомами позволяет улучшить синтез новых веществ и оптимизировать процессы производства различных материалов.
Электронная структура атома и ее роль в химической организации
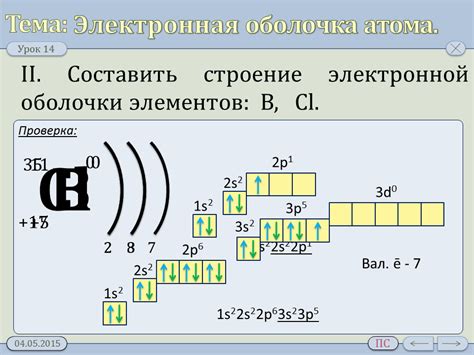
Понимание электронной структуры атома позволяет установить, какие энергетические уровни заняты электронами и как они связаны с распределением электронной плотности. Ведь, именно электронный обмен и взаимодействие определяет поведение атомов при образовании связей между собой и создании химических соединений.
Атомы имеют специфический набор энергетических уровней и подуровней, которые заполняются электронами по определенным правилам, учитывающим принципы квантовой механики. Эта организация электронов в атоме определяет его химические свойства, такие как валентность и возможность образования химических связей с другими атомами.
Важность электронной структуры атома в химии трудно переоценить. Она является фундаментальным знанием, на котором основаны многие теории и концепции химической науки. Понимание электронной структуры атома позволяет предсказывать свойства и реактивность веществ, понять механизмы химических реакций и осознать причину возникновения различных связей и образования молекул.
- Электронная структура атома определяет его химические свойства и реактивность.
- Знание электронной структуры позволяет предсказывать свойства и поведение вещества.
- Понимание электронного строения основа для изучения механизма химических реакций.
- Фундаментальное понимание электронной структуры атома - ключевая составляющая химической науки.
Химическая связь и его роль в формировании химического устройства вещества
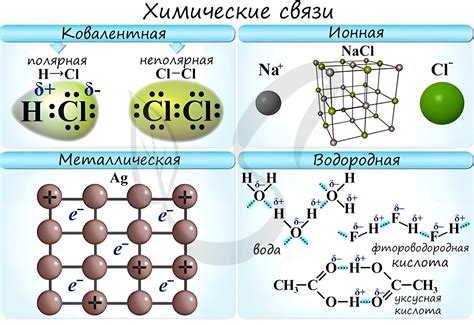
Химическая связь - это физическое явление, которое возникает между атомами, ионофарами или молекулами и обусловливает их прочное взаимодействие. Она обеспечивает силу притяжения между частицами вещества и определяет их пространственное расположение, что влияет на все их химические и физические свойства.
Химическая связь позволяет образовывать различные типы химических соединений, таких как ионные, ковалентные и металлические соединения. В каждом из этих видов связей, атомы или ионы объединяются по определенным правилам и образуют более сложные структуры.
Важно отметить, что тип химической связи влияет на свойства вещества. Например, ионные соединения обладают высокой точкой плавления и жесткостью, так как ионы в них образуют прочную решетку. Ковалентные соединения, в свою очередь, имеют более низкую точку плавления и возможность образовывать различные изомеры, что делает их более подвижными и гибкими.
Таким образом, химическая связь играет фундаментальную роль в формировании химического строения вещества. Она определяет его структуру, свойства и поведение. Понимание химической связи позволяет нам предсказывать и объяснять различные химические процессы, исследовать и создавать новые материалы с уникальными характеристиками.
| Тип связи | Описание | Примеры веществ |
|---|---|---|
| Ионная связь | Связь, образованная взаимным притяжением положительно и отрицательно заряженных ионов | NaCl, MgO, CaCO3 |
| Ковалентная связь | Связь, образованная общими электронными парами между атомами | H2O, CO2, CH4 |
| Металлическая связь | Связь, возникающая между положительно заряженными металлическими ионами и свободно движущимися электронами | Fe, Cu, Ag |
Роль типов химических связей в формировании свойств вещества

В химии существует несколько типов химических связей: ионная, ковалентная и металлическая. Каждый из этих типов связей характеризуется особыми механизмами образования и электронной структурой. Так, ионная связь основана на привлекательных силах между ионами с противоположным зарядом, ковалентная связь формируется путем обмена электронами между атомами, а металлическая связь возникает благодаря общим "облакам" электронов, которые делятся всеми атомами металла.
Тип химической связи определяет не только структуру вещества, но и его физические и химические свойства. Например, вещества с ионными связями обычно обладают высокой температурой плавления и кипения, а также хорошей растворимостью в воде. Вещества с ковалентными связями могут иметь низкую температуру плавления и кипения, а также слабую или отсутствующую растворимость в воде. Металлические связи придают веществам характеристики металлов, такие как хорошая проводимость тепла и электричества.
Взаимодействие различных типов химических связей внутри вещества может приводить к образованию комплексных структур и новых свойств. Например, смешанная ионно-ковалентная связь, наблюдаемая во многих кристаллических соединениях, обеспечивает устойчивость структуры и специфические характеристики. Понимание типов химических связей и их влияния на свойства вещества является ключевым в развитии синтеза новых материалов и оптимизации уже существующих.
Молекулярная конфигурация и ее роль в химической структуре
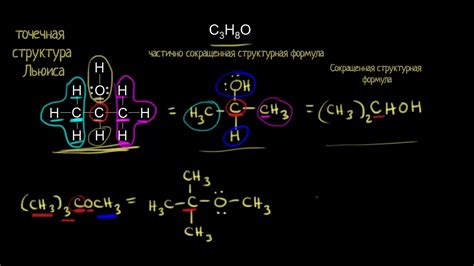
В данном разделе рассматривается вопрос о молекулярной конфигурации и ее важности в химической структуре вещества. Под молекулярной конфигурацией понимается трехмерное пространственное расположение атомов в молекуле их числовых связей. Именно молекулярная конфигурация определяет химические и физические свойства вещества, его реакционную активность и способность образовывать соединения с другими веществами.
Молекулярная конфигурация может быть определена с помощью различных методов, таких как рентгеноструктурный анализ, спектроскопические методы, молекулярная динамика и др. Знание молекулярной конфигурации позволяет понять строение вещества и предсказывать его свойства и поведение в различных условиях.
Определение молекулярной конфигурации имеет огромное значение для различных областей химии, таких как органическая химия, неорганическая химия, физическая химия и др. Знание молекулярной конфигурации позволяет разрабатывать новые материалы с определенными свойствами, контролировать реакции и процессы в химической промышленности, а также понимать природу и механизмы химических реакций.
Взаимодействия между молекулами и их роль в химической структуре
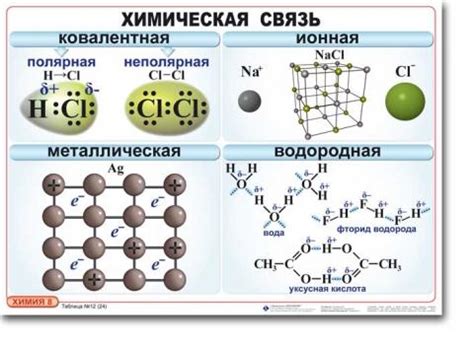
- Интермолекулярное взаимодействие - это явление, при котором молекулы одного вещества взаимодействуют друг с другом, образуя так называемые межмолекулярные силы. Такие силы могут быть различной природы и варьировать в своей силе и значимости для свойств вещества.
- Координационные связи - это особый вид взаимодействия между молекулами, при котором одна молекула донорного вещества передает свои электроны акцепторной молекуле. Это позволяет образованию сложных структурных единиц и способствует формированию свойств вещества.
- Гидрофобные взаимодействия - это взаимодействие между неполярными молекулами, которые образуют силы притяжения из-за разности положительных и отрицательных точек заряда внутри молекулы.
- Электростатическое взаимодействие - это взаимодействие между заряженными молекулами или ионами, которые образуют силы притяжения или отталкивания, в зависимости от знака заряда.
- Дисперсионные силы - это слабое взаимодействие между неполярными молекулами, вызванное временными изменениями электрической поляризованности молекул. Они играют важную роль в свойствах многих веществ, особенно молекул с большой поверхностью.
Взаимодействия между молекулами играют фундаментальную роль в определении химической структуры вещества и его свойств. Разнообразие этих взаимодействий позволяет создавать вещества с различными структурами и свойствами, а также способствует появлению сложных структурных единиц, таких как полимеры и биомолекулы.
Слоистое строение и роль слоев в химии

Слоистое строение играет важную роль в химическом строении некоторых веществ, предоставляя им уникальные свойства и возможности. Слоистая структура состоит из замкнутых слоев, расположенных один над другим, и каждый слой имеет свою определенную роль и функцию.
Во-первых, слоистые материалы обладают уникальными свойствами, благодаря которым они находят широкое применение в различных отраслях промышленности. Благодаря слоям, такие вещества могут образовывать стабильные структуры с определенной пористостью и площадью поверхности. Это позволяет им эффективно взаимодействовать с другими веществами, а также обладать повышенной прочностью и устойчивостью к воздействию различных факторов.
Во-вторых, слоистые материалы могут иметь различный химический состав в каждом слое, что позволяет им демонстрировать различные свойства в зависимости от слоя. Например, такие вещества могут обладать разной степенью проводимости электричества, оптической прозрачностью или магнитными свойствами в зависимости от химической структуры каждого слоя.
| Примеры веществ с слоистым строением: |
|---|
| Графен - одноатомный слой углерода |
| Мицеллы - слоистая структура в микроскопическом масштабе |
| Глины - состоят из слоистых структур с вяжущими ионами |
Кроме того, слоистые вещества могут взаимодействовать с другими веществами за счет эффекта слой-слойной адсорбции или интеркаляции. Эти процессы позволяют изменять свойства вещества, например, увеличивать его пластичность, усиливать или тормозить реакции, а также улучшать его способность связывать и удерживать различные вещества.
Таким образом, слоистое строение играет значительную роль в химическом строении некоторых веществ, обеспечивая им уникальные свойства и возможности. Понимание этого строения способствует разработке новых материалов и технологий, а также открывает перспективы для улучшения существующих процессов и систем.
Роль теории химического строения в современной химии

В настоящее время, современная химия не может обойтись без теории химического строения и все более признает ее ценность и значимость.
- Роль понятия химической структуры состоит в...
- значение теории химического строения заключается в...
- Важность понимания структурных особенностей молекул...
- Внедрение фундаментальных законов химии строения...
- Теория химического строения служит основой для...
- Углубленное изучение структуры веществ позволяет...
Теория химического строения позволяет современной химии не только предсказывать и объяснять свойства веществ, но и разрабатывать новые материалы, эффективные катализаторы и лекарственные препараты. Получение авангардных химических соединений и раскрытие их потенциальных применений недостижимо без понимания химической структуры. Знания о строении молекул позволяют разрабатывать прогрессивные методы синтеза, оптимизировать процессы хранения и транспорта химических веществ.
Глубокое изучение химического строения также открывает новые перспективы в области разработки устойчивых и экологически безопасных технологий. Разработка атомарно-молекулярных систем и наноматериалов немыслима без анализа структурных особенностей веществ. Внедрение неорганических, органических и биологических реакций основано на теории химического строения.
Вопрос-ответ

Какие основные положения теории химического строения?
Основные положения теории химического строения включают в себя идеи о том, что все вещества состоят из атомов, атомы могут объединяться в молекулы, структура молекул определяет свойства вещества, атомы в молекулах связаны химическими связями.
В чем заключается понятие химического строения?
Химическое строение описывает устройство и взаимосвязи атомов в молекулах. Оно определяет, какие элементы составляют вещество, как они связаны между собой и какие свойства обладает данное вещество.
Какое значение имеет теория химического строения?
Теория химического строения имеет огромное значение в химии. Она позволяет понять, как и почему происходят химические реакции, объяснить свойства вещества на молекулярном уровне, позволяет предсказывать и моделировать новые вещества и разрабатывать новые методы синтеза.