В рамках изучения химии на уровне 8 класса, большое внимание уделяется понятию основных оксидов. Что же они представляют собой? Вкратце, основные оксиды – это определенный тип химических соединений, которые образуются в результате реакции металлов с кислородом.
Следует отметить, что основные оксиды являются одним из важных компонентов химических реакций. Они обладают особыми свойствами, которые отличают их от других классов соединений. К примеру, основные оксиды часто обладают щелочными свойствами, то есть они растворяются в воде, образуя щелочные растворы.
Разница между основными оксидами и другими типами оксидов заключается в их химической природе и способе взаимодействия с другими веществами. Именно основные оксиды играют важную роль в процессах коррозии, ржавлении металлов и многих других химических реакциях, встречающихся как в естественных, так и в промышленных условиях.
Понятие и свойства основных оксидов в химии 8 класс
В химии 8 класса изучаются основные оксиды, важные соединения, которые играют значительную роль в химических реакциях и применяются в различных областях нашей жизни. Рассмотрим основные понятия и основные свойства этих веществ.
Важная роль основных оксидов в химических реакциях
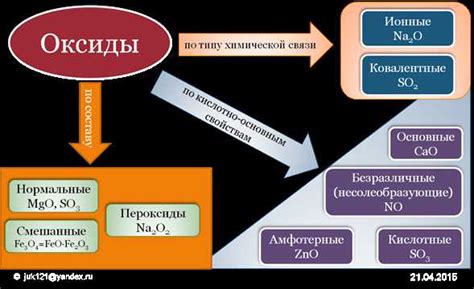
В химических реакциях основные оксиды активно участвуют в процессах окисления и восстановления элементов и соединений. Они могут служить окислителями или восстановителями, способными передавать электроны другим веществам. Это является основой для многих химических реакций, таких, как горение, растворение и многих других.
Основные оксиды могут реагировать с кислотами, образуя соли и воду. Это является основой для формирования основ, солей и других веществ, которые используются во многих областях нашей жизни, от производства удобрений до производства моющих средств.
| Примеры основных оксидов | Химическая формула |
|---|---|
| Кальций оксид | CaO |
| Натрий оксид | Na2O |
| Магний оксид | MgO |
| Алюминий оксид | Al2O3 |
Основные оксиды также могут быть использованы в процессе нейтрализации кислот и щелочей. Их применение распространено в различных сферах, от медицины до пищевой промышленности.
Таким образом, основные оксиды играют важную роль в химических реакциях и представляют собой вещества с уникальными свойствами. Их применение находит широкое применение в различных областях нашей жизни, делая их неотъемлемой частью химии и её приложений.
Особенности характера основных оксидов

Помимо основной функции в химических реакциях, основные оксиды обладают рядом уникальных свойств, которые важны для понимания их роли в химических процессах.
- 1. Щелочные свойства
- 2. Гигроскопичность
- 3. Щелочную реакцию с кислотами
- 4. Электролитическую проводимость
Одним из ключевых признаков основных оксидов является их способность реагировать с водой, образуя щелочные растворы. Это происходит за счет высокой содержащихся в оксидах гидроксильных ионов (OH-), которые при контакте с водой образуют гидроксиды щелочных металлов.
Многие основные оксиды обладают свойством поглощать воду из окружающей среды. Это явление называется гигроскопичностью. Из-за этого свойства основные оксиды, такие как оксид калия или оксид натрия, могут быть использованы в качестве сушильных агентов или в сфере контроля влажности.
Основные оксиды могут вступать в реакцию с кислотами, образуя соли и воду. Это происходит благодаря их щелочным свойствам и способности нейтрализовать кислоты. Такие реакции широко используются в химической промышленности и быту, например, при приготовлении различных продуктов или в процессе очищения воды.
Из-за наличия ионов гидроксила (OH-) в основных оксидах, они обладают электролитической проводимостью в растворе. Это означает, что основные оксиды могут проводить электрический ток, когда растворены или расплавлены. Это свойство важно в химической аналитике и электрохимических процессах.
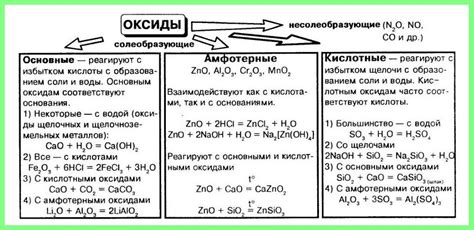
Классификация основных оксидов: структура и состав

Для начала рассмотрим основные оксиды, которые можно классифицировать по их структуре. Один из типов структуры – это ионная структура, где положительные и отрицательные ионы располагаются в решетке кристаллической структуры. Такие оксиды обычно имеют высокую температуру плавления и жесткость. Кроме того, есть оксиды с молекулярной структурой, где молекулы оксидов представляются атомами, связанными химическими связями. Такие оксиды, как правило, имеют низкую температуру плавления и менее прочную структуру.
Далее можно рассмотреть классификацию основных оксидов по их химическому составу. Оксиды могут быть классифицированы на основе их химической формулы и пропорции элементов. Например, некоторые основные оксиды содержат только один металл и кислород, в то время как другие могут содержать несколько металлов и кислород. Также, в зависимости от окислительных свойств, оксиды могут быть классифицированы как оксидирующие или восстановительные.
В результате изучения классификации основных оксидов по их структуре и химическому составу, можно лучше понять особенности их свойств и использование в различных химических процессах. Знание об этих классификациях позволяет углубленно изучить химию и применить полученные знания в решении практических задач, связанных с реакциями оксидации металлов.
Классификация основных оксидов: типы и примеры
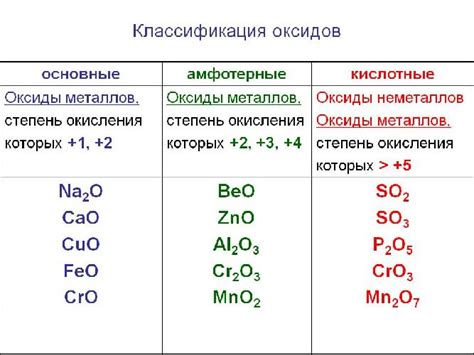
Классификация основных оксидов основана на их составе и реактивности. Эти оксиды характеризуются наличием выраженных основных свойств, то есть способностью образовывать основания при реакции с водой или кислотами. Структурно они состоят из катионов металла и анионов кислорода.
| Тип основного оксида | Примеры |
|---|---|
| Алкалийные оксиды | Натриевый оксид (Na2O), Калиевый оксид (K2O) |
| Алкалиноземельные оксиды | Кальциевый оксид (CaO), Магниевый оксид (MgO) |
| Оксиды щелочноземельных металлов | Бериллиевый оксид (BeO), Стронциевый оксид (SrO) |
Как видно из таблицы, среди основных оксидов существуют различные типы, каждый из которых связан с определенной группой металлов. Натриевый оксид и калиевый оксид относятся к алкалийным оксидам, кальциевый оксид и магниевый оксид - к алкалиноземельным оксидам, а бериллиевый оксид и стронциевый оксид - к оксидам щелочноземельных металлов.
Различные типы основных оксидов имеют разную химическую активность и способность взаимодействовать с другими веществами. У них также могут быть различные применения в различных сферах, например, в производстве щелочей, минеральных удобрений и керамики.
Структурные особенности основных оксидов: описание и свойства
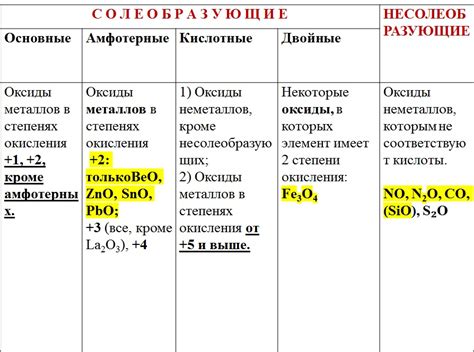
Структурные особенности основных оксидов могут различаться в зависимости от типа металла, его валентности и свойств водородной cвязи. Общим для большинства основных оксидов является наличие кристаллической структуры, состоящей из регулярно расположенных атомов.
Металлические оксиды имеют кристаллическую структуру соединений, в которых атомы металла занимают определенные позиции в решетке кристалла, образуя ионные связи с атомами кислорода. Для некоторых металлов, таких как кальций и натрий, структура оксидов может быть одно-, двух- или трехмерной.
Крахмальные оксиды, или оксиды основательности, также имеют определенную структурную особенность. Они состоят из ионов гидроксида, включенных в кристаллическую решетку. Эти соединения обладают высокой щелочностью и активно участвуют в реакциях нейтрализации с кислотами.
Структурные особенности также определяют физические и химические свойства основных оксидов. Они влияют на их растворимость в воде, электропроводность и степень реакционной активности. Кроме того, структура основных оксидов может быть изменена в результате модификаций или соединения с другими веществами, что расширяет их применение в различных отраслях промышленности и научных исследований.
Помимо структурных особенностей, основные оксиды обладают свойствами, такими как щелочность, коррозионная активность и способность образовывать кислоты при реакции с водой.
Элементы, способные образовывать базовые оксиды

Базовые оксиды - это химические соединения, образующиеся при соединении веществ с кислородом. Они обладают щелочными свойствами и способны взаимодействовать с водой, образуя гидроксиды. Данный тип оксидов возникает в результате реакции активных металлов или неметаллов с кислородом.
Различные элементы периодической системы могут быть амплитудными источниками базовых оксидов. Для этих целей нередко используются такие элементы, как натрий (Na), калий (K), магний (Mg), кальций (Ca), алюминий (Al) и многие другие. Они обладают высокой активностью и легко сшиваются с кислородом, в результате чего образуют базовые оксиды.
Базовые оксиды имеют широкий спектр применения в разных отраслях химии и промышленности. Они могут использоваться для обработки металлов, производства стекла, в качестве катализаторов и еще многочисленных целей.
Важно отметить, что способность элементов образовывать базовые оксиды зависит от их валентности и химических свойств. Некоторые элементы, такие как благородные газы, не образуют базовые оксиды в силу своей низкой реактивности и химической инертности.
Вопрос-ответ

Какие вещества могут быть названы основными оксидами?
Основные оксиды в химии - это вещества, которые обладают щелочными свойствами. К таким оксидам относятся, например, оксид натрия (Na₂O), оксид калия (K₂O) и оксид кальция (CaO).
Каково строение основных оксидов?
Основные оксиды обычно имеют ионное строение. В молекуле оксида металл связан с кислородом. Степень окисления металла в оксиде соответствует его валентности.
Какие свойства обладают основные оксиды?
Основные оксиды обладают следующими свойствами: они растворяются в воде, образуя щелочные растворы; они реагируют с кислотами, образуя соли; и они обладают щелочным вкусом.
Для чего используются основные оксиды в промышленности?
Основные оксиды используются в различных отраслях промышленности. Например, оксид натрия широко используется в стекольной промышленности для придания стеклу особых свойств. Оксид кальция применяется в строительстве для получения цемента. Оксид калия используется в производстве удобрений.