Основные строительные блоки всех веществ, известных человечеству, это без сомнения молекулы. Однако, какова природа их движений? Стремительные перепады температур и резкие изменения давления диктуют свои правила, заставляя наши газовые составляющие танцевать на невидимой площадке.
Вечно в поисках энергии, молекулы газа проявляют всю свою хитрость и изобретательность. Они колеблются, толкаются, сталкиваются между собой, словно непоседливые дети на игровой площадке. Но есть ли в этой полусумасшедшей веренице какой-то порядок, или образование газовой среды уже само по себе является последствием одичавшей свободы молекулярного мира?
Волшебная игра природы, в которой участвуют носители безликости и мелькающие в толпе единицы, раскрывает свои секреты перед исследователями. Неразлучные спутники - тепло и хаос - постоянно присутствуют в межатомных пространствах, раскрывая перед нами удивительные и сразу же исчезающие картинки. Но каков смысл этой таинственной балетной постановки, и какие силы управляют нашими молекулами в неизменно самобытной танцевальной симфонии?
Основы движения частиц газа: где и как они перемещаются?

В данном разделе мы рассмотрим фундаментальные аспекты движения частиц газа и попытаемся вникнуть в их внутренний механизм без использования специфических терминов. Разберем, каким образом газовые частицы движутся внутри емкости, стремясь заполнить всё доступное пространство.
Мы могли бы сравнить движение частиц газа с роем энергичных насекомых, которые постоянно суетятся и перемещаются внутри своего убежища. Эти небольшие частицы газа, будучи небольшими строительными блоками, постоянно оказываются в движении, подобно суматошному танцу, в котором каждая частица старается найти максимально возможное пространство для перемещения.
Количество и направление движения частиц газа определяется его температурой. Чем выше температура, тем более интенсивным и хаотичным становится движение частиц. Они отталкиваются друг от друга и перемещаются в разных направлениях, создавая ощущение непрерывной активности внутри вещества. При более низкой температуре движение замедляется, что также влияет на поведение и свойства газа.
Движение частиц газа можно представить как непрерывную смену коллизий и отталкиваний друг от друга. Молекулы газа, будучи неотъемлемыми частями вещества, неуклонно стремятся найти равновесие, при котором силы притяжения и отталкивания выравниваются. Это непостоянное состояние равновесия создает ощущение динамичности и энергичности в движении частиц.
Объяснение физическими законами: движение частиц вещества при повышенной температуре

Кинетическая теория газов является одним из ключевых физических законов, объясняющих тепловое движение молекул газа. Согласно этой теории, молекулы газа всегда находятся в постоянном движении, что указывает на их кинетическую энергию. В отсутствии внешней силы на эти молекулы, они взаимодействуют друг с другом и со стенками сосуда, причем эти взаимодействия часто неупорядоченны, подобно хаотичным перемещениям частиц.
Закон Джоуля-Томсона, также объясняющий движение молекул газа, устанавливает, что изменение температуры газа происходит при его расширении или сжатии без какого-либо другого энергетического воздействия. В результате такого изменения объема газа, скорость движения молекул также изменяется, что приводит к изменению их кинетической энергии.
Закон сохранения энергии, один из основных принципов физики, гласит, что энергия не может быть создана или уничтожена, а может только преобразовываться из одной формы в другую. В контексте теплового движения молекул газа, это означает, что при повышении температуры газа, его частицы получают дополнительную энергию, что приводит к более интенсивному и хаотичному движению молекул.
Доказательства теплового перемещения частиц вещества: опытные показатели

Этот раздел статьи посвящен представлению конкретных экспериментальных данных, которые подтверждают наличие теплового движения молекул газа. Известно, что частицы вещества постоянно находятся в движении, однако для определения конкретных параметров и характеристик теплового перемещения требуются точные исследования и эксперименты.
| Опыт | Описание |
|---|---|
| Броуновское движение | Этот эксперимент был проведен Робертом Броуном в 1827 году. В ходе наблюдения за мельчайшими частицами пыльцы в воде, он отметил их непредсказуемое и неравномерное движение. Это явление объясняется тепловым движением молекул воды, которое воздействует на частицы пыльцы и заставляет их перемещаться в случайных направлениях. |
| Диффузия | Диффузия представляет собой процесс перемещения молекул из области большей концентрации в область меньшей концентрации. Это обусловлено столкновением и перемещением частиц, вызванным их тепловым движением. Эксперименты, в которых мониторируется скорость диффузии различных веществ, являются непосредственным свидетельством теплового движения молекул газа. |
| Скорость звука | Измерение скорости звука в газах также предоставляет данные о тепловом движении молекул. Скорость звука зависит от средней кинетической энергии молекул, которая, в свою очередь, связана с тепловым движением. Измерения скорости звука позволяют нам получать количественные показатели этого теплового движения в газах. |
Вышеперечисленные экспериментальные данные являются лишь некоторыми примерами, подтверждающими наличие теплового движения молекул газа. Совокупность этих и других экспериментов позволяет получить доказательства и более полное представление о природе и особенностях этого фундаментального явления.
Связь движения молекул газа с его температурой и давлением
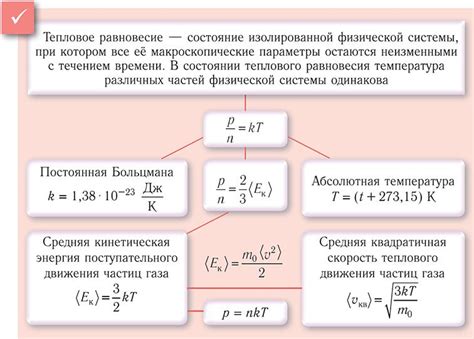
В этом разделе мы рассмотрим, как движение молекул газа связано с его температурой и давлением. Рассмотрим вопросы, касающиеся энергии движения молекул, количества столкновений и их силы, а также взаимодействия молекул с окружающей средой.
- Влияние температуры на движение молекул газа
- Основной фактор, определяющий скорость движения молекул, это их кинетическая энергия. Чем выше температура газа, тем больше кинетическая энергия молекул, и, следовательно, их скорость.
- Понятие теплового движения отражает случайность движения молекул, которое является результатом их тепловой энергии.
- Влияние давления на движение молекул газа
- Давление газа связано с частотой и силой столкновений молекул друг с другом и с поверхностями, с которыми они взаимодействуют.
- Чем больше количество молекул газа и чем сильнее их столкновения, тем выше давление газа.
- Взаимодействие молекул с окружающей средой
- Молекулы газа не движутся в вакууме, они взаимодействуют друг с другом и с другими частицами окружающей среды, такими как молекулы других веществ или поверхности контейнера.
- Взаимодействие молекул с окружающей средой может приводить к изменению их скорости, направления движения и энергии.
Молекулярный характер газа: основные свойства и взаимодействия
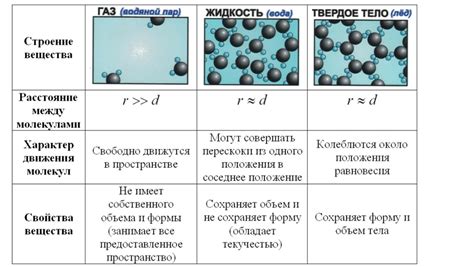
Молекулы газовых веществ обладают определенными химическими и физическими свойствами. Их размеры и формы могут значительно различаться, а также у них есть непосредственное воздействие друг на друга. Эти взаимодействия, как силы отталкивания, так и притяжения, могут оказывать существенное влияние на состояние газа.
Одним из основных свойств молекул газа является их кинетическая энергия. Это указывает на то, что молекулы газа постоянно находятся в движении, в результате которого они сталкиваются друг с другом. Взаимодействие молекул газа определяет такие характеристики, как давление и температура газа.
На кинетическое поведение молекулы газа также влияет их масса. Молекулы с большей массой двигаются медленнее и имеют меньшую кинетическую энергию. В то же время, молекулы с меньшей массой могут двигаться более быстро и обладать большей энергией. Это также влияет на скоростной режим перемещения молекулы.
Взаимодействие молекул газа определяется их силой притяжения друг к другу. Некоторые молекулы газа образуют слабые связи между собой, в результате которых они способны образовывать агрегаты или даже жидкости при определенных условиях. Это вызывает изменение физических свойств газа и его поведение при различных температурах и давлениях.
Межмолекулярные силы в газах: различные типы взаимодействия
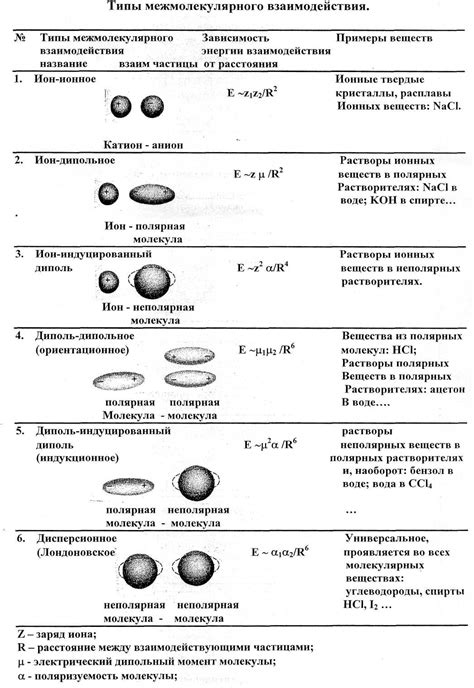
В газах межмолекулярные силы играют важную роль в формировании их свойств и поведения. Они определяют структуру газовой фазы и взаимодействия между молекулами. Такие силы могут быть классифицированы на три основных типа: дисперсное, полярное и водородное взаимодействие.
- Дисперсное взаимодействие - это слабое и кратковременное притяжение между неполярными молекулами газа, основанное на временных изменениях электронной оболочки. Это тип взаимодействия характерен для всех газов и присутствует в любых условиях.
- Полярное взаимодействие - сильное и долговременное притяжение между полярными молекулами газа, обусловленное разделением зарядов в молекуле. Оно проявляется при наличии дипольного момента в молекуле и способствует образованию ассоциаций и более упорядоченной структуры газовой фазы.
- Водородное взаимодействие - сильное притяжение между молекулами, содержащими атомы водорода, связанные с электроотрицательными атомами (кислород, азот, фтор). Этот тип взаимодействия проявляется в особенности у водородных соединений и имеет существенное значение в биологических системах.
Понимание и изучение различных типов межмолекулярных сил в газах позволяет лучше понять и объяснить их поведение и свойства. Это имеет важное значение для различных областей науки и технологии, таких как химия, физика и биология.
Уравнение состояния идеального газа: связь с движением молекул
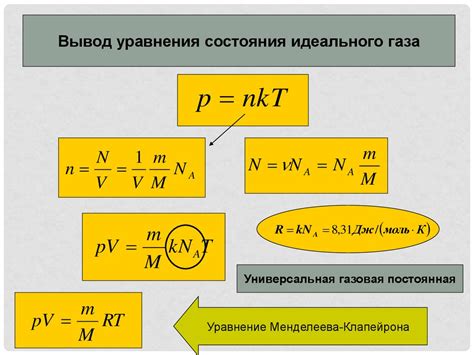
Движение молекул в идеальном газе можно описать с помощью кинетической теории газов. По этой теории, молекулы газа находятся в постоянном хаотическом движении, меняя направление и скорость своего движения. Они сталкиваются друг с другом и со стенками сосуда, в котором содержится газ.
Кинетическая энергия молекул газа, связанная с их движением, приводит к повышению температуры среды. Тепловое движение молекул создает давление в газовом объеме, так как они сталкиваются со стенками сосуда и оказывают на них силу. Уравнение состояния идеального газа учитывает эту зависимость между давлением и объемом газа.
| Уравнение состояния идеального газа: | PV = nRT |
Где P - давление газа, V - объем газа, n - количество вещества (в молях), R - универсальная газовая постоянная, T - абсолютная температура газа. Уравнение показывает, что при постоянной температуре, увеличение давления газа приводит к уменьшению его объема, а при постоянном объеме, увеличение давления приводит к повышению температуры газа.
Таким образом, уравнение состояния идеального газа связано с движением молекул газа, учитывая их тепловое движение и энергию, которую они обладают. Понимание этой связи позволяет более точно предсказывать и описывать поведение идеального газа в различных условиях.
Вопрос-ответ

Молекулы газа неподвижны или движутся?
Молекулы газа постоянно находятся в состоянии движения. Их движение является результатом их тепловой энергии. Это означает, что молекулы газа никогда не являются неподвижными и всегда находятся в постоянном хаотическом движении.
Какое влияние оказывает тепловое движение на свойства газа?
Тепловое движение молекул газа имеет важное влияние на его свойства. Благодаря этому движению газ подчиняется законам термодинамики и обладает особыми свойствами, такими как давление, объем и температура. Кроме того, тепловое движение молекул газа определяет его способность распространяться и смешиваться с другими газами.
Может ли тепловое движение влиять на объем газа?
Да, тепловое движение молекул газа влияет на его объем. При нагревании газа, молекулы обретают большую кинетическую энергию и начинают двигаться быстрее. Это приводит к увеличению их среднего расстояния друг от друга, что, в свою очередь, приводит к увеличению объема газа. Таким образом, тепловое движение играет важную роль в изменении объема газа под воздействием изменения температуры.



