Все мы знакомы с понятием атома - основной строительной единицы вещества. Он имеет свою внутреннюю структуру, которая долгое время была объектом исследования ученых. Однако вы только представьте, что атом обладает не только своим внутренним миром, но и своим "внешним" энергетическим уровнем.
Этот энергетический уровень необычен и интересен во многих аспектах. Он является своего рода "местом обитания" для электрона, одной из элементарных частиц, которая окружает ядро атома. Как мы знаем, электрон вращается вокруг ядра на определенных орбитах, и каждое из этих "мест" на орбите имеет свои особенности и свою энергию.
Таким образом, местоположение внешнего энергетического уровня в атоме имеет огромное значение и влияет на его свойства. На этом уровне происходят различные химические реакции и взаимодействия, которые определяют поведение атомов в химических соединениях. Кроме того, энергетический уровень может быть переходным состоянием, когда электрон, получив энергию от внешнего источника, временно занимает более высокую энергетическую орбиту.
Роль расположения атома на внешнем энергетическом уровне: важность и специфика
Взаимодействие атомов внутри вещества зависит от расположения каждого атома на внешнем энергетическом уровне. Расположение этого уровня влияет на структуру и свойства вещества, определяя его способность реагировать с другими веществами, проводить электрический ток, образовывать кристаллическую решетку и многое другое.
Ключевые вопросы:
- Какое значение имеет расположение атома на внешнем энергетическом уровне?
- Как расположение внешнего энергетического уровня влияет на вещества?
- Какие особенности и свойства обусловлены местоположением атомов на внешнем энергетическом уровне?
Ознакомление с этими вопросами и понимание значения местоположения атома на внешнем энергетическом уровне помогут нам расширить наши знания о строении и свойствах веществ, а также позволят применять эти знания для разработки новых материалов и технологий.
Основные черты структуры внешней оболочки атома
В данном разделе рассмотрим главные особенности внешней оболочки атома, которые играют ключевую роль в его взаимодействии с окружающей средой и определяют ряд характерных свойств и связей.
| Черта | Описание |
|---|---|
| Валентность | Способность атома участвовать в химических реакциях и образовании химических связей с другими атомами. Она связана с числом электронов в внешней оболочке и влияет на степень его реакционной активности. |
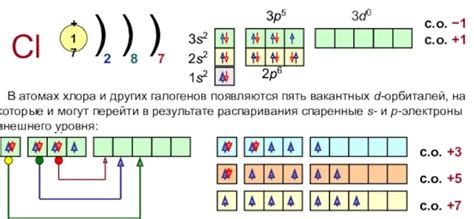
| Iонизационный потенциал | Энергия, необходимая для удаления одного электрона из внешней оболочки атома. Значение ионизационного потенциала определяет стабильность атома и его склонность к образованию ионов. |
| Электроотрицательность | Свойство атома притягивать электроны во внешнюю оболочку при образовании химических связей. Высокая электроотрицательность означает большую склонность атома к привлечению электронов и образованию ионов. |
| Радиус | Характеристика размера атома, которая определяется расстоянием от его ядра до внешней оболочки. Размеры атома могут варьироваться в зависимости от его положения в периодической системе и количества электронов во внешней оболочке. |
Эти и другие особенности внешней оболочки атома оказывают существенное влияние на его свойства и реакционную активность. Изучение и понимание этих характеристик позволяет лучше понять процессы, происходящие на микроуровне вещества и взаимодействие атомов в химических реакциях. Наличие или отсутствие определенных свойств внешней оболочки могут определять возможность образования стабильных соединений или способствовать разрушению молекул и атомов в химических реакциях.
Роль расположения внешнего энергетического уровня в химических свойствах атома
Позиция, на которой находится энергетический уровень вовне от ядра атома, существенно влияет на его способность вступать в химические реакции и взаимодействия с другими атомами. Это расположение играет фундаментальную роль в описании и понимании различных химических свойств и реакций.
Важность Внешней Оболочки
Внешняя оболочка атома, состоящая из внешних энергетических уровней, определяет его химические свойства. Как поведение атома в реакциях, так и его реакционная способность определяются его электронной конфигурацией. Внешние энергетические уровни, на которых находятся электроны, предоставляют атомам возможность образования химических связей с другими атомами и участие в химических реакциях.
Вариативность энергетических уровней
Атомы могут иметь различное количество энергетических уровней, в том числе и внешних. Эти уровни могут быть заполнены различным числом электронов, что создает разнообразие химических свойств атомов. Они могут быть насыщенными, иметь лишние или нехватку электронов, что влияет на их реакционную способность и способность участвовать в химических связях.
Периодическая таблица элементов
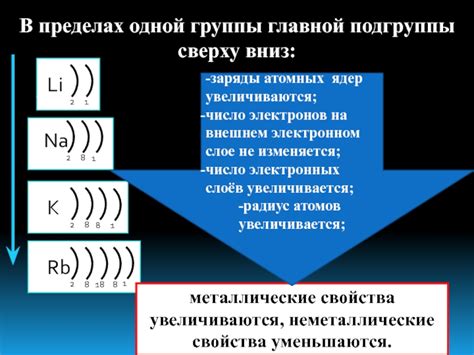
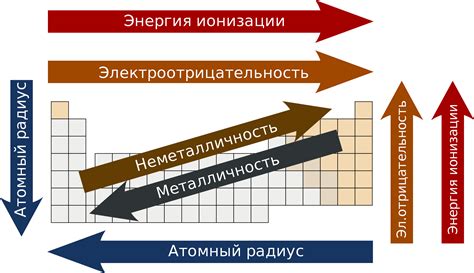
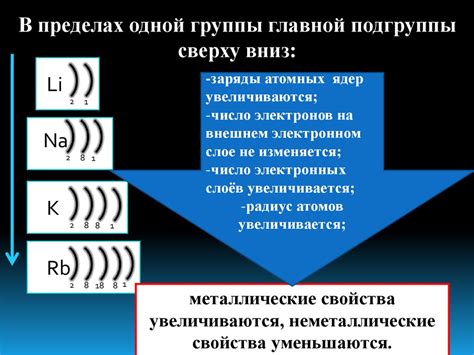
С помощью периодической таблицы элементов можно классифицировать атомы по их электронной конфигурации и определить их химические свойства. Расположение атома в определенной группе и периоде в периодической таблице указывает на его энергетический состав и влияет на его химические свойства. Например, атомы одной группы имеют одно и то же количество электронов во внешней оболочке, что дает им сходные химические свойства.
Расположение внешнего энергетического уровня в атоме играет определяющую роль в его химических свойствах. Это связано с электронной конфигурацией и способностью атома взаимодействовать с другими атомами. Изучение влияния и особенностей местоположения энергетических уровней позволяет глубже понять и объяснить химические свойства и реакции атомов.
Взаимодействие внешней энергетической оболочки с другими атомами

Роль внешней энергетической оболочки в протекании химических реакций и взаимодействии атомов невозможно недооценить. Состоящая из электронов, эта область вокруг атома формирует его химические свойства и позволяет ему обмениваться энергией с окружающей средой. Важно отметить, что каждый атом имеет определенную степень электроотталкивания и электроаттрактивности в своей внешней оболочке, что определяет способность атомов образовывать связи друг с другом.
Взаимодействие атомов с помощью электромагнитных сил является основой взаимодействия внешней энергетической оболочки между атомами. Заряженные частицы, такие как электроны, создают электромагнитные поля, которые взаимодействуют между собой. Этот процесс позволяет атомам притягиваться или отталкиваться друг от друга в зависимости от их электроотталкивающих и электроаттрактивных сил внешней оболочки.
Формирование химических связей между атомами основывается на взаимодействии их внешних энергетических оболочек. Приближение атомов друг к другу и образование связей между ними приводит к стабильному состоянию системы и энергетически выгодным положениям. Такие связи могут быть ковалентными, ионными или металлическими, и их характер определяется взаимодействием внешних оболочек атомов.
Влияние сил притяжения и отталкивания внешних энергетических оболочек атомов проявляется во множестве физических и химических процессов. Взаимодействие может приводить к образованию структур различной сложности, от молекул до кристаллических сеток, а также определяет свойства вещества, такие как температура плавления и кипения, электропроводность и многие другие.
Исследования и понимание взаимодействия внешней энергетической оболочки атомов являются важной задачей для развития химии и материаловедения. Различные модели и теории позволяют описывать и предсказывать реакции и свойства веществ, основываясь на взаимодействии атомов и их внешних энергетических оболочек.
Реакционная активность атомов в зависимости от их энергетических характеристик
В данном разделе мы рассмотрим взаимосвязь энергетических характеристик атомов и их способности вступать в химические реакции. Реакционная активность атомов определяется не только их энергетическим уровнем, но и распределение заряда, электронной оболочкой и числом валентных электронов.
Атомы с высоким энергетическим потенциалом обладают большей склонностью к реакциям, так как они обладают большим количеством свободной энергии, которую можно использовать для образования и разрыва химических связей. Однако, реакционная активность атомов также зависит от распределения зарядов в молекуле и наличия свободных электронов.
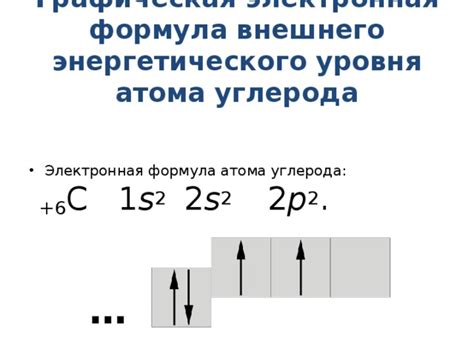
- Валентные электроны являются основными участниками химических реакций и определяют реакционную активность атомов. Атомы с полностью заполненными внешними энергетическими уровнями (например, инертные газы) обычно проявляют низкую или отсутствующую реакционную активность.
- Наличие свободных электронов в внешней оболочке атома также может существенно влиять на его способность участвовать в химических реакциях. Атомы с неполностью заполненными энергетическими уровнями могут обладать высокой реакционной активностью, так как они стремятся завершить свою электронную конфигурацию путем образования или разрыва связей.
- Распределение зарядов в молекуле также играет роль в определении реакционной активности атомов. Например, атомы с положительным зарядом (катионы) обычно проявляют большую склонность к реакциям, так как они привлекают электроны из окружающей среды. С другой стороны, атомы с отрицательным зарядом (анионы) могут быть более реакционно-инертными, так как они имеют избыточную электронную плотность.
Все эти факторы в совокупности определяют реакционную активность атомов, которая в свою очередь играет важную роль во многих химических процессах, от взаимодействий в органической химии до реакций, происходящих внутри ядер атомов.
Роль позиции внешнего энергетического уровня в структуре электронов атома
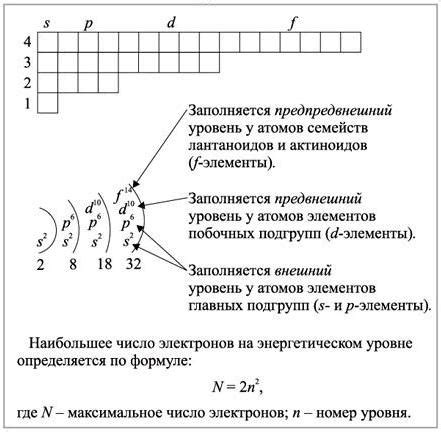
В структуре атома электроны занимают различные энергетические уровни, которые могут быть описаны с помощью понятия "позиция внешнего энергетического уровня". Эта позиция играет важную роль в формировании электронной структуры атома, определяя его основные характеристики и свойства.
Функция внешнего энергетического уровня. Позиция внешнего энергетического уровня определяет вероятность взаимодействия атома с другими атомами или молекулами. Чем ближе энергетический уровень к ядру, тем меньше вероятность такого взаимодействия. Наоборот, энергетический уровень, находящийся дальше от ядра, имеет большую вероятность формирования химических связей и реакций с другими атомами или молекулами.
Важность энергетического уровня для химической активности. Количество электронов, занимающих энергетический уровень атома, определяет его химическую активность. Атомы с неполным внешним энергетическим уровнем стремятся завершить его, путем получения или отдачи электронов. Это позволяет атому образовывать химические связи и участвовать в реакциях с другими атомами, что является основой для образования различных химических соединений.
Влияние энергетического уровня на физические свойства. Внешний энергетический уровень также оказывает влияние на физические свойства атома, такие как электронная конфигурация, размер, ионная радиус и т. д. Изменение энергетического уровня может приводить к изменению этих свойств и, соответственно, влиять на химическую и физическую активность атома.
Заключение. Таким образом, позиция внешнего энергетического уровня в электронной структуре атома играет ключевую роль в определении его химической и физической активности. Понимание и контроль над этой позицией позволяет управлять реакционной способностью атома и разрабатывать новые материалы и соединения с желаемыми свойствами.
Количество электронов на внешнем энергетическом уровне и химическая активность атома
Сосредоточение электронов на внешнем энергетическом уровне атома оказывает значительное влияние на его химическую активность. Количество электронов, находящихся на внешнем энергетическом уровне, определяет готовность атома взаимодействовать с другими атомами и образовывать химические соединения.
Атомы с полностью заполненным внешним энергетическим уровнем, таким как инертные газы, обладают низкой химической активностью, поскольку не имеют незаполненных мест для образования химических связей. С другой стороны, атомы с неполностью заполненным внешним энергетическим уровнем склонны участвовать в реакциях, чтобы достичь более стабильного состояния. Они могут принимать или отдавать электроны, образуя ионные связи, или совместно использовать электроны с другими атомами, образуя ковалентные связи.
Количество электронов на внешнем энергетическом уровне определяет также формирование валентной оболочки атома. Атомы с полностью заполненной валентной оболочкой имеют максимальную стабильность и обладают наибольшей химической инертностью. Наоборот, атомы с неполностью заполненной валентной оболочкой, имеющие от одного до семи электронов на внешнем энергетическом уровне, обладают большей химической активностью и способностью к образованию различных химических соединений.
- Количество электронов на внешнем энергетическом уровне влияет на химическую реакционную способность атома.
- Атомы с полностью заполненным внешним энергетическим уровнем обладают низкой химической активностью.
- Атомы с неполностью заполненным внешним энергетическим уровнем более склонны к образованию химических связей.
- Количество электронов на внешнем энергетическом уровне определяет формирование валентной оболочки атома.
- Атомы с полностью заполненной валентной оболочкой имеют максимальную стабильность и химическую инертность.
- Атомы с неполностью заполненной валентной оболочкой обладают высокой химической активностью и способностью к образованию различных химических соединений.
Формирование химической связи на основе расположения наружного энергетического уровня

Расположение наружного энергетического уровня атома играет ключевую роль в процессе формирования химической связи между атомами. Этот уровень определяет возможность атома вступить в химическую реакцию с другими атомами и участвовать в образовании молекул.
Расположение наружного энергетического уровня атома влияет на его химические свойства и способность образовывать соединения. Например, атомы с одним электроном на внешнем энергетическом уровне обладают большей реакционной активностью и могут легко образовывать связи с другими атомами. Атомы с полностью заполненным наружным энергетическим уровнем (восемь электронов) имеют низкую реакционную активность и обычно не образуют связей.
Формирование химической связи на основе расположения наружного энергетического уровня происходит через обмен или совместное использование электронов между атомами. Атомы, не достигшие оптимальной энергетической конфигурации, могут совместно использовать электроны во внешних энергетических уровнях, образуя ковалентные связи. При этом электроны проводят время как на одном атоме, так и на другом, что делает связь стабильной и обеспечивает обоим атомам большую энергетическую стабильность.
Таким образом, расположение наружного энергетического уровня атома играет решающую роль в формировании химической связи, определяя его реакционную активность и способность образовывать связи с другими атомами. Понимание этого явления позволяет углубиться в механизмы химических реакций и открыть новые возможности в области синтеза и модификации соединений.
Суммируя вышеизложенное, можно заключить, что местонахождение и определение внешнего энергетического уровня атома имеют значительное значение для его поведения и свойств. Расположение атома на данном уровне прямо влияет на его интеракции с другими атомами и молекулами, а также на его реакционную способность и энергетическую структуру.
Местоположение внешнего энергетического уровня атома также определяет его химическую активность, способность образовывать связи и реагировать с другими элементами. Это является одним из ключевых факторов в формировании химических связей и образовании соединений.
Особенности местоположения внешнего энергетического уровня атома также могут привести к образованию различных ионов и изомеров, что влияет на их свойства и возможность участвовать в различных химических реакциях.
Таким образом, понимание и изучение местоположения внешнего энергетического уровня атома позволяет получить более глубокие знания о его поведении и реакционных свойствах, что имеет широкое практическое применение в различных областях, включая химию, физику и материаловедение.
Вопрос-ответ

Как местоположение внешнего энергетического уровня атома влияет на его свойства и взаимодействия с другими атомами?
Местоположение внешнего энергетического уровня атома определяет его химические свойства и способность вступать в химические реакции с другими атомами. Атомы с полностью заполненными внешними энергетическими уровнями, как правило, более устойчивы и менее склонны к реакциям. Атомы с неполностью заполненными внешними энергетическими уровнями, наоборот, более активны и готовы вступать в химические реакции с другими атомами для достижения более стабильного состояния.
Какие особенности местоположения внешнего энергетического уровня атома следует учитывать при изучении его химических свойств?
При изучении химических свойств атомов важно учитывать количество валентных электронов на их внешнем энергетическом уровне, а также их распределение по подуровням. Количество валентных электронов определяет, сколько связей атом может образовать, а распределение по подуровням позволяет понять, какие энергетические уровни будут наиболее доступными для взаимодействия с другими атомами.
Как наличие свободного слоя внешних электронов на атоме влияет на его электропроводность?
Наличие свободного слоя внешних электронов делает атомы электропроводными. Электрический ток может проходить через вещество благодаря электронам, которые свободно передвигаются внутри материала. Если атом имеет неполностью заполненный внешний энергетический уровень, то такие электроны могут легко оторваться от атома и передвигаться по материалу, создавая электрический ток.
Как местоположение внешнего энергетического уровня в атоме влияет на его реакционную способность?
Местоположение внешнего энергетического уровня атома напрямую влияет на его реакционную способность. Атомы с неполностью заполненными внешними энергетическими уровнями имеют некоторую энергетическую нестабильность, которую они могут компенсировать путем вступления в химические реакции. Это связано с их стремлением достичь более устойчивого состояния путем обмена или передачи электронов с другими атомами.
Какое влияние имеет местоположение внешнего энергетического уровня атома?
Местоположение внешнего энергетического уровня атома имеет огромное влияние на его химические и физические свойства. Оно определяет, как атом будет взаимодействовать с другими атомами и молекулами, и может влиять на его реакционную активность, степень окисления и способность образовывать связи.
Какие особенности связаны с местоположением внешнего энергетического уровня атома?
Одной из особенностей является то, что местоположение внешнего энергетического уровня диктует количество электронов, находящихся в этой энергетической области. Также, внешний энергетический уровень определяет периодические свойства атомов, такие как радиус, электроотрицательность и многие другие характеристики элементов.