Связи между атомами являются определяющими факторами в химических реакциях и обладают фундаментальным значением для понимания структуры и свойств веществ. Два основных типа связей, которые можно обнаружить в молекулярных соединениях - это ионная и ковалентная связи. Хотя оба эти вида связей участвуют в формировании химических соединений, существуют существенные различия между ними, которые могут быть определены с помощью ряда ключевых факторов.
Ионная связь в химии отличается тем, что происходит обмен электронами между атомами с разными электроотрицательностями. В результате электроотрицательный атом становится отрицательно заряженным и называется анионом, а атом с меньшей электроотрицательностью - положительно заряженным катионом. Значительная разница в электроотрицательности приводит к тому, что электроны переносятся от одного атома к другому, создавая стабильные ионы. Такая связь обычно образуется между металлом и неметаллом, что приводит к образованию кристаллической решетки.
Ковалентная связь, в свою очередь, основана на общем использовании электронных пар атомами с схожей электроотрицательностью. В этом случае, два атома идентично делят электроны, образуя молекулу стабильных и электронейтральных атомов. Такая связь обычно образуется между неметаллами, такими как кислород, углерод и азот. Ковалентная связь нередко проявляет идеально одинаковую тенденцию электроотрицательности и использует синергическую работу двух атомов для обеспечения устойчивости молекулы.
Основы и особенности ионной связи
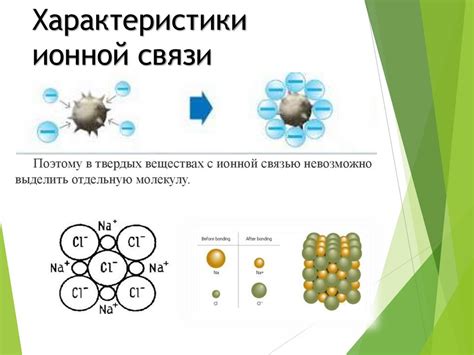
В отличие от ковалентной связи, где электроны общие и находятся между атомами, ионная связь возникает при образовании ионов, которые притягиваются друг к другу силой противоположных зарядов. При этом, один из атомов становится положительно заряженным (катионом), а другой – отрицательно заряженным (анионом).
- Ионная связь вещества проявляется, например, в образовании кристаллических структур, где положительные ионные радиусы окружаются отрицательными ионными радиусами, образуя упорядоченную решетку.
- Свойства ионной связи определяются силой ионного взаимодействия и растворимостью веществ в различных средах. Взаимодействие ионов приводит к образованию кристаллов или ионных молекулярных соединений, которые часто обладают высокой твердостью и температурой плавления.
- Применение ионной связи находится в таких областях, как химия, электротехника, фармакология и др. Ионные соединения широко используются в качестве катализаторов, удобрений и веществ с определенными физическими свойствами.
- Определение и выявление ионной связи подразумевает анализ химической структуры и свойств соединений при использовании различных методов и инструментов, таких как рентгеноструктурный анализ, спектроскопия и электронная микроскопия.
Ионная связь – важный и широко распространенный тип химической связи, который играет фундаментальную роль во многих сферах науки и технологий. Детальное изучение особых принципов и характеристик ионной связи позволяет более глубоко понять ее природу и улучшить практическое применение данного типа связи.
Принципы образования и особенности ковалентной связи
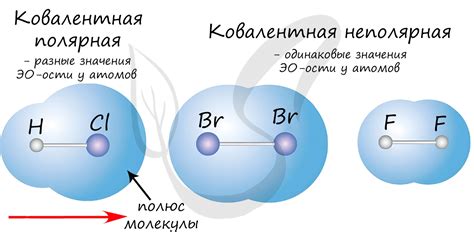
В данном разделе мы рассмотрим основные принципы формирования ковалентной связи и ее характеристики. Ковалентная связь представляет собой тип химической связи, при котором элементы объединяются путем обмена электронами и образования пары или нескольких пар электронов между связываемыми атомами.
Основная идея ковалентной связи состоит в том, что атомы стремятся достигнуть наиболее стабильного состояния, заполнив свои внешние электронные оболочки. Для этого они могут делить одну или несколько пар электронов с соседними атомами, образуя так называемую общую пару. Эти общие пары электронов создают связь между атомами, обеспечивая их структурную устойчивость и образование молекулы.
| Основные принципы образования ковалентной связи: |
| - Обмен пар электронов между атомами; |
| - Образование общих пар электронов и общих электронных облаков; |
| - Связь формируется при неконтактном взаимодействии атомов; |
| - Образование структурной устойчивости и молекулярной структуры; |
Ковалентная связь характеризуется такими свойствами, как длительность существования, прочность и энергия связи, геометрическая конфигурация молекулы и химическая активность образованных соединений. Важно отметить, что энергия связи в ковалентных соединениях значительно выше, чем в ионных соединениях, что связано с более плотным расположением электронов и общими парами электронов между атомами.
Электроотрицательность и связь: как узнать тип соединения
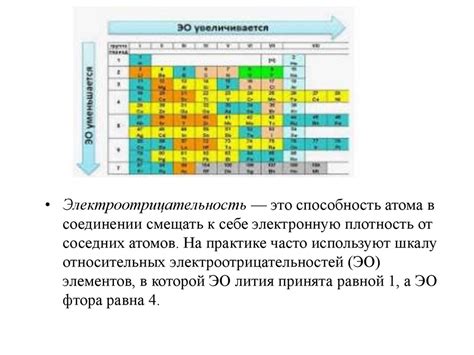
Электроотрицательность отражает способность атома или молекулы притягивать к себе электроны в химической связи. Чем выше электроотрицательность, тем сильнее атом или молекула притягивает электроны. В данном разделе мы рассмотрим, как электроотрицательность помогает определить тип связи.
Для начала рассмотрим ионную связь. В ионной связи атомы отдают или приобретают электроны, образуя положительные и отрицательные ионы. Типичными примерами ионных соединений являются соли и металлы с не-металлами. Основная характеристика ионной связи - большая разница в электроотрицательности между атомами, что приводит к образованию ионов.
В отличие от ионной связи, в ковалентной связи электроны делятся между атомами. В результате образуется общая оболочка электронов, которая обеспечивает стабильность молекулы. Такие связи часто встречаются в органических и неорганических соединениях. Важным критерием ковалентной связи является близкая электроотрицательность между атомами, что приводит к равномерному распределению электронов между ними.
Формула расчета электроотрицательности
Раздел, посвященный формуле расчета электроотрицательности, предоставляет возможность лучше понять суть данного физико-химического понятия. Здесь будет представлена формула, которая позволит определить степень электроотрицательности вещества, без использования ключевых терминов, которые обычно присутствуют при изучении различной химической связи. Электроотрицательность можно рассматривать как меру способности вещества привлекать электроны к себе в химической связи.
Формула расчета электроотрицательности позволяет установить разницу электроотрицательности между двумя атомами, что, в свою очередь, помогает понять характер связи между ними. Чем больше разница в электроотрицательности, тем сильнее полярна или ионна связь между атомами. В противном случае, если разница электроотрицательности незначительна, связь является неполярной или ковалентной.
Основная формула, используемая для расчета электроотрицательности, основывается на шкале Полинга (также известной как энергетическая шкала Полинга). Эта шкала представляет собой числовой ряд, в котором каждый химический элемент имеет свое уникальное значение электроотрицательности. Для определения разницы электроотрицательности между атомами, достаточно вычесть значение электроотрицательности одного атома из значения другого.
Примером применения данной формулы может быть расчет разницы электроотрицательности водорода и кислорода, которая является ключевым индикатором их химической связи.
- Шаг 1: Находим электроотрицательность водорода в шкале Полинга.
- Шаг 2: Находим электроотрицательность кислорода в шкале Полинга.
- Шаг 3: Вычитаем значение электроотрицательности водорода из значения электроотрицательности кислорода.
Результат расчета позволяет определить, что разница электроотрицательности между водородом и кислородом соответствует полярной связи, что указывает на присутствие химической связи между этими элементами.
Примеры и практическое применение знания о различных типах химических связей

В процессе изучения химии, важно понимать основные принципы и различия между ионными и ковалентными связями. Несмотря на то, что эти типы связей имеют свои уникальные характеристики, их практическое применение может быть обнаружено во многих аспектах нашей повседневной жизни.
Пример 1: Ионные связи
Ионные связи формируются благодаря электростатическому притяжению между положительно и отрицательно заряженными ионами. Один из самых распространенных примеров ионной связи - образование солей, таких как хлорид натрия (NaCl). Это вещество является основным компонентом кухонной поваренной соли, которая широко используется в кулинарии для усиления вкуса и сохранения пищевых продуктов.
Пример 2: Ковалентные связи
Ковалентные связи возникают, когда два атома делают обмен электронами для образования пары электронов, называемой ковалентной связью. Примером ковалентной связи является молекула воды (H2O). Благодаря этим ковалентным связям между атомами кислорода и водорода, возникают уникальные свойства воды, такие как высокая теплопроводность, способность к образованию водородных связей и уникальная структура льда.
Практическое применение знаний о типах связей
Знание о типах химических связей имеет широкий спектр практического применения в различных областях. Научившись определять, какие связи присутствуют в данной химической структуре, мы можем понять и прогнозировать ее свойства и потенциальные реакции с другими веществами. Это знание может быть полезным в процессе разработки новых лекарственных препаратов, создания новых материалов с определенными свойствами, а также в понимании фундаментальных процессов, происходящих в природе.
В итоге, понимание различий между ионными и ковалентными связями и осознание их практического применения дает нам возможность взглянуть на химию через призму повседневных явлений и расширить наше понимание мира вокруг нас.
Вопрос-ответ

Какие основные отличия между ионной и ковалентной связью?
Ионная связь возникает между атомами, когда один из них, отдавая или получая электроны, становится положительным или отрицательным ионом, и образуется притяжение между ионами разного заряда. Ковалентная связь, напротив, возникает при совместном использовании электронов одними и теми же атомами. В этом случае образуются молекулы, состоящие из атомов, которые связаны между собой общими электронами. Таким образом, ключевыми отличиями являются: разная природа связи (связь между ионами и связь через общие электроны), образование ионов в ионной связи и молекул в ковалентной связи, различное направление энергетических изменений при образовании и разрыве связей.
Как можно определить, является ли связь между атомами ионной или ковалентной?
Определить тип связи можно, проанализировав разницу в электроотрицательности атомов. Если электроотрицательности атомов различаются значительно, то связь может считаться ионной. В случае, когда электроотрицательности атомов близки или имеют незначительную разницу, связь скорее всего будет ковалентной. Однако, стоит отметить, что в реальности часто встречаются смешанные типы связи, где присутствуют ионные и ковалентные характеры одновременно. Для точного определения типа связи могут использоваться различные экспериментальные методы, такие как рентгеноструктурный анализ или молекулярная спектроскопия.
Какие последствия приводят к разным направлениям энергетических изменений при образовании и разрыве ионной и ковалентной связи?
При образовании ионной связи энергия образования связи обычно является отрицательной, так как происходит выделение энергии. В то время как энергия разрыва ионной связи положительна, так как для разрыва связи требуется вложение энергии. В случае с ковалентной связью, энергия образования и разрыва связи могут быть как положительными, так и отрицательными, в зависимости от характера образования молекулы и реакций. Ковалентная связь обычно более прочная, чем ионная, так как для ее разрыва требуется больше энергии.