В химической науке существует превеликое множество элементов и соединений, которые могут быть очень похожими друг на друга. И одним из таких парных сопоставлений являются кислоты и соли. Несмотря на то, что эти два вещества имеют сходные свойства и могут быть использованы в различных областях, их различить важно, чтобы избежать непредвиденных последствий и определить их конкретное применение.
Прежде чем погрузиться в детали определения кислоты и соли, нам следует понять, что их различает на самом базовом уровне. Кислоты и соли представляют собой основные классы химических соединений, которые обладают уникальными физическими и химическими свойствами.
Основные отличия между кислотами и солями
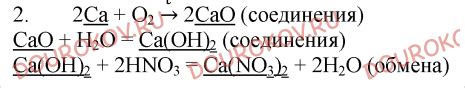
В данном разделе мы рассмотрим основные характеристики, которые позволяют отличить кислоты от солей. При изучении химических соединений, важно обратить внимание на их свойства и состав, чтобы понять их уникальные особенности и влияние на окружающую среду.
Одной из ключевых особенностей, которая помогает различить кислоты и соли, является их реакция с водой. Кислоты проявляют кислотность, образуя водные растворы с характерными кислотными свойствами, такими как кислотный вкус, способность изменять цвет индикаторов и повышать проводимость электрического тока. Соли, в свою очередь, при растворении в воде образуют нейтральные растворы, не обладающие кислотными или щелочными свойствами.
Еще одним важным отличием между кислотами и солями является их химическая формула. Кислоты обычно имеют формулу, в которой водород соединен с кислородом и некоторым другим элементом. Соли же состоят из положительного и отрицательного ионов, которые обычно представлены металлом и неметаллом соответственно. Это позволяет отличать кислоту от соли уже на химическом уровне.
Кроме того, физические свойства могут помочь в определении кислот и солей. Кислоты обычно выглядят как жидкости или газы, и они обладают кислотным запахом. Соли, напротив, могут быть как твердыми соединениями, так и водными растворами, и они не имеют характерного запаха.
Наконец, еще одним важным отличием между кислотами и солями является их использование и роль в природе и жизнедеятельности организмов. Кислоты играют важную роль в желудочно-кишечном тракте человека и других организмов, участвуя в процессах пищеварения. Соли, с другой стороны, широко используются в различных отраслях, таких как пищевая промышленность, сельское хозяйство и медицина.
Химическое строение и состав
В данном разделе мы рассмотрим основные химические характеристики и состав кислот и солей, чтобы смочь отличить их друг от друга.
- Различия в структуре молекул. Кислоты и соли имеют разную организацию атомов и связей между ними. Кислоты обычно состоят из водородных и кислородных атомов, а соли формируются из различных элементов, включая металлы.
- Растворимость в воде. Кислоты и соли могут отличаться по своей растворимости в воде. Некоторые кислоты полностью растворяются и образуют кислотные растворы, а соли могут быть как растворимыми, так и нерастворимыми в воде.
- Природа ионов. Кислоты образуют положительные ионы в растворе, называемые катионами, в то время как соли образуют отрицательные ионы, или анионы. Это также является важным признаком для различения кислот и солей.
- Кислотность и основность. Кислоты являются кислотными соединениями и способны задействовать протоны при реакции, в то время как соли могут быть как кислыми, так и основными.
- Реакции с индикаторами. Использование химических индикаторов может помочь различить кислоты и соли. Например, кислоты обычно изменяют цвет индикаторов на кислотный, а соли не вызывают изменений цвета или вызывают основные реакции.
Реакция веществ с водой

В данном разделе мы рассмотрим поведение веществ при контакте с водой и реакции, которые происходят в результате этого взаимодействия. Знание этих реакций позволит нам различить кислоту и соль, опираясь на их химические свойства.
Вода, являясь универсальным растворителем, способна взаимодействовать с различными веществами, порождая разнообразные химические реакции. При контакте с водой кислоты и соли проявляют различные свойства и характеристики, которые могут помочь нам их отличить друг от друга.
| Реакция с водой | Кислота | Соль |
|---|---|---|
| Увеличение концентрации водородных ионов (H+) | Присутствие реакции, образование кислотного раствора | Отсутствие реакции |
| Изменение pH | Увеличение концентрации ионов водорода (низкий pH) | Отсутствие изменения pH |
| Выделение газа | Возможно выделение газов при реакции с водой | Отсутствие выделения газов |
Вкусовые характеристики

Различие между кислотой и солью можно обнаружить не только по химической структуре и внешнему виду, но и по вкусовым характеристикам, которые помогают определить эти два вещества.
| Характеристика | Кислота | Соль |
|---|---|---|
| Кислый вкус | Имеет выраженную кислотность, как лимонный сок | Не имеет кислого вкуса |
| Соленый вкус | Может иметь незначительную соленость | Имеет сильно выраженный соленый вкус |
| Острая пикантность | Не имеет остроты | Может иметь острую, перченую нотку |
| Горький привкус | Может иметь легкую горечь | Не имеет горького привкуса |
| Сладкий вкус | Не имеет сладкости | Не имеет сладкости |
Таким образом, кислота имеет выраженный кислый вкус, может являться слегка соленым, иметь легкую горечь и отсутствие сладости. Соль, в свою очередь, обладает сильно выраженным соленым вкусом, может иметь острую нотку, но не содержит кислинки, горечи или сладости.
Реакция со металлами
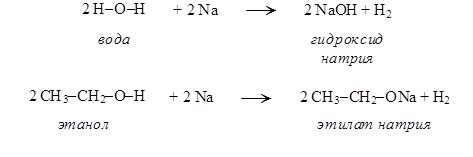
Реакция с металлами - это химический процесс, в котором кислота или соль вступают во взаимодействие с металлическим элементом, образуя химический соединение - соль или газ. Такой вид реакции часто сопровождается явными наблюдаемыми изменениями, такими как выделение газов, изменение цвета или формы вещества, образование осадка и т. д.
В результате реакции с металлами образуется соль или газ, и это является ключевым для их отличия друг от друга. Каждый металл реагирует с кислотами и солями по-разному, в зависимости от своей реакционной активности. Ключевым фактором является реакционная способность металла, определяющая степень его активности во время взаимодействия с кислотой или солью.
Кислоты, обладающие кислыми свойствами и способностью выделять ион водорода, реагируют с металлами, образуя соль и выделяя водородный газ. Например, кислота соляная реагирует с цинком, их обменная реакция приводит к образованию хлорида цинка и выделению водорода.
Соли, являющиеся результатом реакции кислоты с основанием, также могут взаимодействовать с металлами. Однако, реакция солей с металлами имеет свои особенности и не всегда приводит к выделению газов. Например, соль купороса реагирует с металлом железа, образуя гидроксид железа и сернокислый купорос. В данном случае, реакция не сопровождается выделением газов, а лишь приводит к изменению состава и свойств веществ.
Физические свойства вещества

В данном разделе рассматриваются физические характеристики, позволяющие отличить кислоты от солей. Эти характеристики могут быть использованы для определения химических соединений без необходимости проведения лабораторных экспериментов.
| Свойство | Кислоты | Соли |
|---|---|---|
| Вкус | Кислый | Не имеют вкуса |
| Растворимость | Растворяются в воде | Растворяются в воде |
| Состояние | Могут находиться в жидком или газообразном состоянии | Находятся в твердом состоянии |
| Проводимость электричества | Проводят электрический ток при растворении в воде | Проводят электрический ток при растворении в воде |
| Температура плавления | Могут иметь различные точки плавления | Имеют определенную точку плавления |
Вышеуказанные характеристики являются лишь общими и могут варьироваться в зависимости от конкретных свойств каждого химического соединения. Тем не менее, они предоставляют базовые данные для идентификации и различения кислот и солей без проведения специальных химических анализов.
Механизмы формирования кислот и солей: их сущность и образование
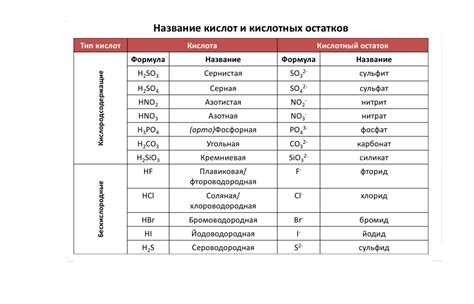
В данном разделе рассмотрим принципиальные особенности образования кислот и солей. Формирование данных веществ может происходить различными путями и механизмами, в зависимости от природы реагирующих веществ и условий реакции.
- Процесс образования кислот
- Механизмы солеобразования
- Основные реакции при образовании кислот и солей
- Роль катализаторов в процессе формирования кислот и солей
Важно отметить, что формирование кислот и солей основывается на различии свойств и способностей химических элементов и соединений. Реакции могут происходить с участием различных классов органических и неорганических соединений, что определяет многообразие механизмов образования кислот и солей.
Выявление этих механизмов является важным аспектом в химическом анализе, поскольку позволяет определить тип и состав вещества на основании его реактивности и химических свойств. Следовательно, понимание механизмов формирования кислот и солей является ключевым фактором для успешной идентификации данных классов веществ.
Применение в быту и промышленности

Рассмотрим разнообразные области, где кислоты и соли находят свое применение. Эти вещества играют важную роль как в повседневной жизни, так и в промышленных сферах, значительно влияя на нашу бытовую комфортность и процессы производства.
| В быту | В промышленности |
|---|---|
| 1. Домашнее использование кислот и солей включает их применение в кулинарии, приготовлении пищи и консервировании продуктов. Кислоты используются для подкисления и придания вкуса различным блюдам. Соли являются неотъемлемой частью нашего стола и используются для соления и приправления. | 1. Многие промышленные процессы требуют использования кислот и солей. Кислоты широко применяются в химической промышленности, производстве удобрений, обработке металлов и других отраслях. Соли находят применение в производстве стекла, щелочей, удобрений, жидкостных растворов и многих других продуктов. |
| 2. Кислоты и соли также используются в бытовых очистителях, моющих средствах, средствах для чистки и обеззараживания поверхностей. | 2. В промышленности кислоты и соли обнаруживают широкое применение в процессах очистки от примесей, обезжиривания, нейтрализации, регулирования pH-уровня и других технологических операциях. |
| 3. Кислоты и соли используются в производстве косметических и санитарных средств, в том числе шампуней, гелей для душа, зубных паст и многих других продуктов. | 3. Промышленные секторы, такие как текстильная, бумажная, пищевая, также используют кислоты и соли в своих процессах для добивания определенных характеристик и свойств конечного продукта. |
Таким образом, кислоты и соли находят широкое применение и в бытовых условиях, и в промышленных сферах. С их помощью достигается необходимая кислотность или щелочность, поддерживается стабильность pH-уровня, производятся важные химические реакции и создаются продукты, которые сопровождают нас повседневно.
Методы определения кислот и солей
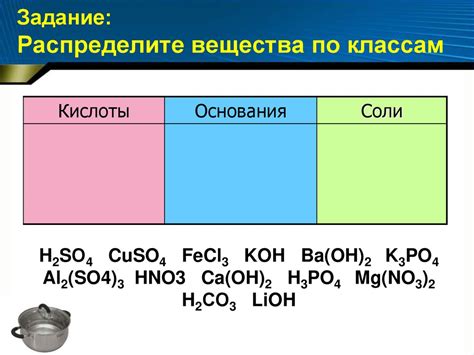
В данном разделе рассмотрим различные способы определения кислот и солей, используемые для их идентификации и дифференциации. При изучении состава и свойств веществ важно иметь навыки определения их химической природы, чтобы правильно классифицировать их как кислоты или соли. В этом помогут различные методы анализа и экспериментальные приемы.
- Кислотные свойства
- Основные методы определения кислот
- Колориметрический метод
- Электротензиометрический метод
- Кислотно-основные титрования
- Растворимость солей
- Присутствие ионов в растворах
- Электролиз
Успешное применение этих методов позволит не только определить природу вещества, но и дать представление о его химических свойствах и возможных применениях. Важно помнить, что каждый метод имеет свои ограничения и требует определенных условий для работы. Комбинация разных методов может быть эффективной стратегией для обобщенного анализа кислот и солей.
Вопрос-ответ

Как можно различить кислоту и соль с помощью внешних признаков?
Кислоты и соли внешне отличаются друг от друга. Кислоты имеют кислый вкус, они могут вызвать жжение или покалывание при контакте с кожей или слизистыми оболочками. Соли же обладают соленым вкусом и не вызывают подобных ощущений при контакте с кожей.
Каким образом можно определить кислоту и соль по их растворимости в воде?
Растворимость кислот и солей в воде различается. Кислоты обычно хорошо растворяются в воде, при этом происходит их диссоциация на ионы водорода. Соли также обычно растворяются в воде, но при этом не происходит диссоциации на ионы водорода.
Есть ли у кислот и солей различия в свойствах при нагревании?
Кислоты и соли имеют различные свойства при нагревании. Кислоты, как правило, образуют пары при нагревании, при этом они могут испаряться, выделять газы или даже сгорать. Соли, в свою очередь, не образуют пары при нагревании и могут изменять свою структуру или цвет.
Можно ли различить кислоту от соли с помощью индикаторов?
Да, известные индикаторы могут помочь в различении кислот и солей. Например, индикаторы кислотности, такие как фенолфталеин или универсальный индикатор, меняют цвет при контакте с кислотой, но остаются без изменений при контакте с солью. Таким образом, можно определить наличие кислоты.
Какие методы определения кислоты и соли используются в химическом анализе?
В химическом анализе для определения кислоты и соли используются различные методы. Например, методом кондуктометрии можно определить концентрацию кислоты или соли в растворе, основываясь на проводимости этого раствора. Также используются специфические реакции, которые могут показать наличие либо кислоты, либо соли в пробе.