В нашем мире существует так много чудесных явлений, о которых мы даже не задумываемся. Одним из таких феноменов являются изотопы водорода и их обозначения. И хотя на первый взгляд это может показаться сложной и непонятной темой, она скрывает секреты, которые могут изменить наш взгляд на множество областей нашей жизни.
Изотопы водорода, представляющие собой атомы водорода с разным числом нейтронов, оказывают огромное влияние на различные области науки и технологий. Каждый из них обладает своими уникальными свойствами и способностями, которые делают их незаменимыми инструментами в современном мире.
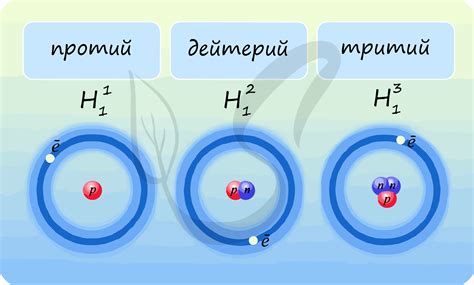
Одним из самых известных изотопов водорода является, пожалуй, дейтерий. Его обозначение - D. Дейтерий, в отличие от обычного водорода, имеет один нейтрон в своем ядре. Из-за этой простой разницы, свойства дейтерия кардинально отличаются от свойств обычного водорода. Он обладает большей массой и стабильностью, что делает его незаменимым элементом в научных исследованиях и технических процессах.
Роль изотопов водорода в химии
Изотопы водорода, отличающиеся от обычного водорода наличием одного или двух дополнительных нейтронов в ядре, играют значительную роль в химии и имеют широкое применение в различных областях науки и техники.
Одним из основных свойств изотопов водорода является их различная масса, что влияет на физические и химические свойства вещества, в котором они присутствуют. Таким образом, изотопы водорода могут вносить существенные изменения в химические реакции, каталитические процессы и спектроскопические исследования.
Дейтерий – один из изотопов водорода, обладает двумя дополнительными нейтронами и является нередко используемым веществом для исследования механизмов химических реакций. Его применение особенно ценно в изучении кинетики химических процессов, так как благодаря большей массе дейтерия можно получить более точные данные о молекулярных движениях и взаимодействиях.
Тритий , еще один из изотопов водорода, содержит три нейтрона и широко применяется в ядерной энергетике и радиационных исследованиях. Радиоактивность трития позволяет использовать его в качестве источника радиации в различных областях экспериментальной химии и физики.
Благодаря своей уникальной структуре и свойствам, изотопы водорода могут быть использованы в различных областях химии, таких как фармацевтика, пищевая промышленность и материаловедение. Их применение позволяет осуществлять маркировку и отслеживание химических соединений, а также исследовать структуру и свойства различных молекул.
Основные вариации и обозначения водорода

Одним из основных изотопов водорода является дейтерий. Дейтерий содержит один протон, один электрон и один нейтрон в ядре. Обозначается он символом "D". Дейтерий имеет несколько интересных свойств и находит широкое применение в различных областях науки и технологий.
Еще одним изотопом водорода является тритий. Тритий имеет один протон, один электрон и два нейтрона в ядре. Он обозначается символом "Т" и отличается от дейтерия и обычного водорода своими радиоактивными свойствами. Тритий находит применение в ядерной энергетике и в качестве источника радиации для разных научных исследований.
Разнообразие вариантов водорода

Водород, характеризующийся самым простым атомом в периодической системе элементов, не так прост, как он кажется на первый взгляд. В действительности, существует несколько форм водорода, отличающихся по своим физическим и химическим свойствам.
Одним из таких вариантов является тяжелый водород, также известный как дейтерий. Сравнивая его с обычным водородом, можно заметить, что тяжелый водород имеет дополнительный нейтрон в своем ядре. Это приводит к отличиям в структуре и свойствах, которые могут оказать значительное влияние на его реакционную способность.
Еще одним интересным вариантом водорода является тритий. Он обладает двумя дополнительными нейтронами, что делает его еще тяжелее и более редким. Тритий активно используется в ядерных реакторах и имеет важное применение в сфере ядерной энергетики.
Понимание различий между разными изотопами водорода является важным для научного и технического прогресса. Систематическое исследование и использование разных вариантов водорода позволяет нам создавать новые материалы, разрабатывать новые процессы и находить инновационные решения в различных отраслях науки и технологий.
Создание разнообразия в составе водорода
В этом разделе рассматривается процесс образования изотопов водорода и их влияние на химические и физические свойства вещества.
- Различия в составе водорода происходят из-за наличия разных изотопов, которые отличаются по количеству нейтронов в своем атоме. Данные изотопы обладают сходными химическими свойствами, но могут изменять физические свойства вещества, такие как плотность и температура плавления.
- Образование разнообразных изотопов водорода происходит в природе во время ядерных реакций в звездах, а также при процессе ядерного деления и синтеза в лабораторных условиях.
- Наиболее распространенный изотоп водорода - протий, который состоит из одного протона и не имеет нейтронов. Его наличие в изобилии определяет химические и физические свойства обычной воды.
- Другие изотопы водорода, такие как дейтерий и тритий, имеют дополнительные нейтроны, что приводит к изменению химических и физических свойств вещества. Дейтерий встречается в природе в меньшем количестве, а тритий является радиоактивным изотопом, производимым искусственно.
Изучение процесса образования изотопов водорода позволяет лучше понять его свойства и применение в различных областях науки и техники. Это особенно важно при исследовании химических реакций, квантовой физики и создании новых материалов с улучшенными свойствами.
Особенности основных изотопов водорода

В этом разделе мы рассмотрим особенности свойств различных вариантов водорода, взглянув на каждый из них более подробно. Узнаем, чем они отличаются друг от друга и какие уникальные характеристики определяют их поведение в различных условиях.
Начнем с изотопа под названием дейтерий – вещества, содержащего один протон и один нейтрон в ядре водорода. Дейтерий, известный также как тяжелый водород, отличается от обычного водорода более высокой плотностью и более высоким кипящим и точкой замерзания. Также его присутствие в составе воды может оказывать влияние на химические реакции и биологические процессы.
Еще одним изотопом водорода, имеющим особенности, отличные от дейтерия и обычного водорода, является тритий. Он содержит один протон и два нейтрона и обладает еще более высокой массой и плотностью, чем дейтерий. Тритий используется в ядерных реакциях и в качестве источника энергии.
Не следует забывать и о таком изотопе, как протий – наиболее распространенной форме водорода. Он обладает самой низкой массой и не имеет нейтронов в своем ядре. Это делает его самым легким и наиболее подвижным изотопом водорода, обеспечивая такие свойства, как хорошая растворимость в воде и высокую теплопроводность.
- Дейтерий – тяжелый водород, отличается высокой плотностью и точкой замерзания;
- Тритий – изотоп с высокой массой, используется в ядерных реакциях;
- Протий – наиболее распространенный изотоп, обладает низкой массой и хорошей растворимостью.
Каждый из этих изотопов водорода имеет свои особенности, которые определяют их поведение и применение в различных областях науки и технологии.
Закодированные символы: расшифровка обозначений изотопов водорода
Одним из самых распространенных изотопов водорода является дейтерий. Его обозначение состоит из двух символов, которые характеризуют его уникальные свойства. Секретные комбинации этих символов помогают отличить дейтерий от других изотопов водорода.
Еще одним изотопом водорода является тритий. В его обозначении также использованы специальные символы, которые подчеркивают особенности трития и отличают его от остальных изотопов.
Расшифровка обозначений изотопов водорода позволяет нам лучше понять их химические свойства и использовать их в различных областях. Например, изотопы водорода широко применяются в ядерной энергетике, медицине, анализе веществ и многих других сферах науки.
Международная система обозначений изотопов

В мире науки существует Международная система обозначений, которая дает универсальные коды для идентификации изотопов элементов. Эта система разработана для обеспечения однозначности обозначений и упрощения коммуникации между учеными разных стран и специальностей.
Несмотря на то, что изотопы водорода не названы напрямую в заголовке, они являются важной частью Международной системы обозначений изотопов. Водород имеет три основных изотопа: протий, дейтерий и тритий. Каждый из них имеет свою уникальную массу и может использоваться в различных научных и практических областях.
| Изотоп | Обозначение |
|---|---|
| Протий | ^1H |
| Дейтерий | ^2H |
| Тритий | ^3H |
Протий, самый распространенный изотоп водорода, имеет атом с одним протоном и нулем нейтронов. Дейтерий, также известный как тяжелый водород, имеет атом с одним протоном и одним нейтроном. Тритий, самый редкий изотоп водорода, содержит один протон и два нейтрона в атоме.
Изотопы водорода и их обозначения играют важную роль в научных исследованиях и промышленности. Они применяются в ядерной энергетике, радиоактивной маркировке, медицине, а также в химических и физических исследованиях. Благодаря Международной системе обозначений, ученые могут легко распознать имена и обозначения изотопов водорода по всему миру и проводить совместные исследования для предоставления новых открытий и разработок.
Обозначение водородных изотопов в Российской Федерации

В этом разделе мы рассмотрим специальные обозначения, используемые в Российской Федерации для обозначения изотопов водорода. Изотопы, являющиеся вариациями атомов водорода, играют важную роль в различных научных и практических областях. Они имеют свои уникальные характеристики, которые могут быть использованы для различных целей.
В Российской Федерации существует система специальных обозначений, которая позволяет идентифицировать конкретные изотопы водорода. Эти обозначения основаны на стандартах, установленных национальными научными исследовательскими институтами и учреждениями.
Одним из изотопов водорода является тяжелый изотоп дейтерий. Его обозначение в Российской Федерации основано на использовании специального символа, который сочетает строчную букву "Д" со стрелкой вниз. Такое обозначение позволяет быстро и легко распознать дейтерий в различных контекстах.
- Обозначение дейтерия: Д⇩
Другим изотопом водорода является тритий - радиоактивный изотоп водорода. Тритий имеет особое обозначение, которое также основано на специальной символике. Для трития используется комбинация строчной буквы "Т" и знака радиоактивности - символа, напоминающего плюс в круге. Такое обозначение помогает отличить тритий от других изотопов и научиться его идентифицировать.
- Обозначение трития: Т⊕
Знание обозначений изотопов водорода в Российской Федерации имеет важное значение для различных областей науки и технологий. Это помогает ученым и специалистам в точной идентификации изотопов, их использовании в различных исследованиях и разработках. Также, эти обозначения помогают обеспечить безопасность и эффективность использования изотопов в различных отраслях национальной экономики.
Использование различных форм водорода в современных технологиях

Различные формы водорода, включая его изотопы, играют важную роль во множестве современных технологий и находят применение в разных областях жизни. В данном разделе рассмотрим некоторые из них, уделяя внимание особенностям и важности каждого вида водорода.
| Тип водорода | Применение |
|---|---|
| Тяжелый водород (деутерий) | Используется в ядерной энергетике и воздушном транспорте для производства ракетного топлива. Тяжелый водород также используется в химических исследованиях и фармацевтической промышленности. |
| Тритий | Широко применяется в ядерной энергетике, особенно в физических экспериментах, а также в производстве ядерного оружия. Тритий также используется в производстве световых источников, в медицинском оборудовании и в научных исследованиях. |
| Параллельный водород | Найдет применение в области синтеза химических соединений, в производстве специальных полимерных материалов, в катализе реакций, а также в изучении структуры и механизма реакций органических соединений. |
| Атипичный водород | Применяется в рентгеновской кристаллографии для определения структуры сложных молекул, в исследованиях квантовой механики и в некоторых методах анализа веществ. |
Таким образом, использование различных изотопов водорода играет значительную роль во множестве промышленных, научных и медицинских областей, позволяя совершенствовать существующие технологии и разрабатывать новые методы исследования.
Роль водородных изотопов в ядерной энергетике
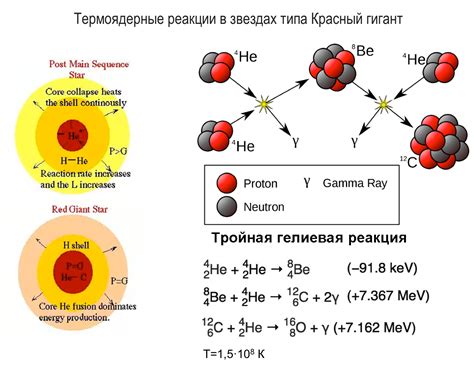
Возможности использования специальных вариантов водорода в важной отрасли энергетики позволяют обеспечить эффективное производство электроэнергии без значительного ущерба для окружающей среды. Сочетание устойчивости и возможности контролирования технологических процессов создает благоприятные условия для генерации энергии на основе ядерного деления и синтеза.
Одним из существенных преимуществ использования водородных изотопов является их доступность и распространенность в природе. Кроме того, отдельные изотопы гидрогена обладают уникальными свойствами, которые значительно улучшают эффективность и безопасность процессов производства энергии.
Важно упомянуть, что использование водородных изотопов в ядерной энергетике не является новой идеей. Эти материалы широко применяются в целях производства электроэнергии и исследования в различных странах мира. Технологические разработки в области нуклеарной энергетики, связанные с водородом, изучаются специалистами уже десятилетиями. Применение этих изотопов обеспечивает огромный потенциал в генерации надежной и экологически чистой энергии для будущего.
Таким образом, использование водородных изотопов в ядерной энергетике представляет собой перспективное решение для эффективного и безопасного производства электроэнергии. Постоянное развитие и исследования в этой области открывают новые возможности и перспективы для устойчивого и экологически чистого энергетического сектора.
Вопрос-ответ

Что такое изотопы водорода?
Изотопы водорода - это различные формы атомов водорода, которые отличаются по числу нейтронов в ядре. Естественный водород состоит преимущественно из двух изотопов: протия (обычный водород) и дейтерия. Протий не имеет нейтронов в ядре, в то время как дейтерий содержит один нейтрон.
Как обозначаются изотопы водорода?
Обозначение изотопов водорода основано на их относительной массе. Обычный водород или протий обозначается как Н-1, в то время как дейтерий обозначается как Н-2. Также существует тритий (Н-3), который содержит два нейтрона и имеет очень нестабильное ядро, поэтому встречается в очень малых количествах и используется в некоторых ядерных реакциях.
Каково применение изотопов водорода?
Изотопы водорода имеют широкое применение в науке и промышленности. Например, дейтерий используется в ядерной энергетике и ядерных реакциях, а также в качестве трассировочного агента для исследования биохимических процессов. Тритий используется в ядерных реакциях и может быть использован в качестве источника радиоактивных излучений. Более легкий изотоп, протий, используется повсеместно в химии и физике, а также как топливо для различных видов техники, включая ракеты и автомобили на водородных топливных элементах.



