Путешествие в магический мир химических элементов начинается с анализа их расположения на умопомрачительной таблице Менделеева. Однако, прежде чем мы приступим к изучению отдельных уровней и периодов периодической системы, следует рассмотреть общую идею организации этой информационно-структурной конструкции. Где же скрывается тайна расположения уровней и как она помогает нам понять особенности свойств и взаимодействий различных элементов?
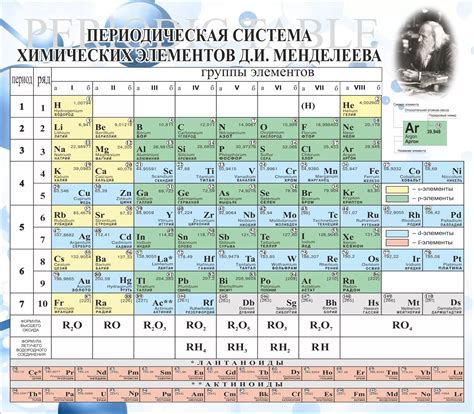
Периодическая система является результатом гениального труда Дмитрия Ивановича Менделеева, который в 19 веке сумел усмотреть общие закономерности в поведении и свойствах химических элементов. Расположение в таблице определенных уровней помогает нам лучше понять строение атомов и их электронную конфигурацию. Химики разработали систему группировки элементов по сходству химических свойств и электронной структуре, отраженной на уровнях.
Используя зрительное восприятие и логику, таблица Менделеева представляет элементы в виде горизонтальных рядов, называемых периодами, и вертикальных столбцов, известных как группы. Однако, на самом деле, вся эта конструкция скрывает более глубокую организацию. Уровни - это энергетические оболочки атомов, на которых размещены электроны. Каждый уровень имеет свой предельный номер электрона, что отражается в его геометрической форме в таблице Менделеева.
Основные принципы устройства таблицы Менделеева
- Строки в таблице Менделеева называют периодами. Каждый период обозначает новый энергетический уровень, на котором расположены электроны.
- Столбцы в таблице представляют собой группы элементов, имеющих схожие химические свойства. Группы элементов отображают общую конфигурацию внешней электронной оболочки.
- Главные группы – группы элементов, расположенных вертикально в таблице, имеют от одного до восьми электронов на внешнем уровне.
- Подгруппы – это последние два ряда главных групп, которые расположены в периодах 6 и 7. Они имеют свои уникальные химические свойства.
- Внутренние переходные металлы находятся между группами 2 и 3 в таблице Менделеева и имеют специфические электронные структуры.
Общая структура таблицы Менделеева позволяет видеть закономерности в размещении элементов, что помогает химикам и ученым предсказывать или анализировать химические свойства различных элементов. Эта система абстрактно отражает внутренний мир атомов и позволяет легче изучать их взаимодействия и реактивность.
Расположение рядов и вертикальных групп в периодической таблице химических элементов
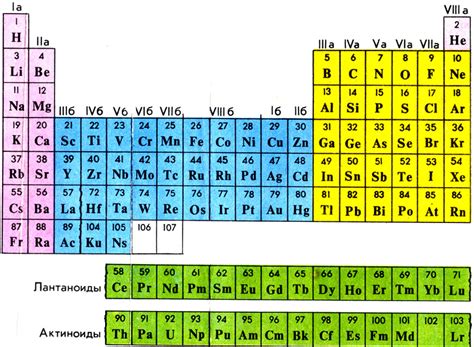
В периодической системе элементов, разработанной ученым Д. И. Менделеевым, элементы организованы таким образом, чтобы представить их химические свойства и отношения. Расположение элементов в таблице Менделеева отражает их электронную структуру и образует специальную организацию, учитывающую основные закономерности в химии.
Периодическая таблица Менделеева состоит из нескольких рядов, которые периодически повторяются. Каждый ряд состоит из элементов, имеющих одинаковое количество электронных оболочек или энергетических уровней. При этом, можно отметить, что количество элементов в ряду увеличивается с каждым последующим рядом.
Вертикальные группы в таблице Менделеева объединяют элементы с аналогичной химической реактивностью и тенденцией к образованию химических соединений. Каждая группа имеет уникальное название и номер, используемый для идентификации элемента в таблице. Главные группы (1-2 и 13-18) расположены слева и справа от периодической таблицы, а переходные металлы занимают центральную часть таблицы.
Расположение рядов и вертикальных групп в периодической таблице Менделеева является ключевым элементом при изучении свойств и взаимодействий химических элементов. Понимание основных закономерностей и тенденций в распределении элементов в таблице облегчает их классификацию, а также помогает предсказывать и объяснять их химическое поведение.
| 1 | 2 | 3 | ... | 16 | 17 | 18 |
|---|---|---|---|---|---|---|
| H | He | Li | ... | S | Cl | Ar |
| ... | Be | B | ... | A | K | Ca |
| ... | ... | ... | ... | ... | ... | ... |
Как уровни организованы в каждом периоде?

В периодической системе элементов, уровни электронных оболочек атомов распределены определенным образом в каждом периоде. Эти уровни синхронизируются с энергетическими уровнями, на которых находятся электроны в атоме, и играют важную роль в определении химических свойств элементов. Рассмотрим, как уровни организованы в каждом периоде периодической системы.
- На первом энергетическом уровне в каждом периоде находится один s-уровень. Этот уровень может содержать только 2 электрона.
- На втором энергетическом уровне в каждом периоде находится один s-уровень и три p-уровня. S-уровень также может содержать 2 электрона, а каждый p-уровень - 6 электронов.
- На третьем энергетическом уровне в каждом периоде находится один s-уровень, три p-уровня и пять d-уровня. S-уровень содержит 2 электрона, каждый p-уровень - 6 электронов, а каждый d-уровень - 10 электронов.
- После третьего энергетического уровня начинаются f-уровни, которые находятся во внешней части периодической системы. Эти уровни имеют более сложную структуру и могут содержать до 14 электронов.
Таким образом, уровни атомных оболочек каждого периода периодической системы располагаются по определенной схеме, которая определяется энергетическими уровнями электронов в атомах. Знание этой организации позволяет лучше понять строение и свойства различных элементов.
Взаимосвязь между уровнями и энергетическими уровнями атомов
В периодической системе элементов существует не только удобное расположение химических элементов, но также важная связь между уровнями атомов и их энергетическими состояниями. Уровни атомов, которые могут быть заполнены электронами, играют ключевую роль в определении химических свойств элементов.
Энергетические уровни атома представляют собой дискретные значения энергии, которые атом может иметь. Каждый уровень имеет свою энергию и может содержать определенное количество электронов. Чем ближе уровень к ядру, тем ниже его энергия и тем более стабильными являются находящиеся на нем электроны.
Уровни атома в таблице Менделеева представлены вертикальными строками, называемыми периодами. Каждый новый период соответствует появлению нового энергетического уровня в атомных оболочках. Атомы с одинаковым количеством энергетических уровней находятся в одной вертикальной группе, которые обозначаются номерами от 1 до 18.
Заполнение энергетических уровней происходит в соответствии с принципом строения атома, известным как правило Клечковского. Согласно этому правилу, электроны заполняют уровни, начиная с наименьшей энергии и постепенно двигаются к уровням с более высокой энергией.
- Наименьшая энергетическая уровень называется первым уровнем, обозначается буквой K.
- Второй уровень - второй по энергии, обозначается буквой L.
- Третий уровень - третий по энергии, обозначается буквой M.
- И так далее, пока не будут заполнены все доступные уровни в атоме.
Осознание взаимосвязи между уровнями и энергетическими состояниями атомов позволяет понять, почему различные элементы имеют разные химические свойства и способность образовывать соединения. Знание расположения уровней атомов в периодической системе помогает ученым классифицировать и изучать элементы, а также предсказывать их реактивность и взаимодействие с другими веществами.
Как заполняются электроны на уровнях в приведенной систематической таблице химических элементов?

В химии существует систематическая таблица химических элементов, в которой представлена информация о различных элементах и их свойствах. Один из важных аспектов этой таблицы заключается в расположении электронов на уровнях внешней оболочки атомов.
Уровни электронных оболочек в систематической таблице представлены с помощью горизонтальных строк, называемых периодами. Каждый период представляет собой набор уровней, на которых могут находиться электроны. Уровни оболочек обозначаются числами, начиная с 1 и увеличиваясь по мере увеличения расстояния от ядра атома.
Заполнение уровней электронами происходит по определенным правилам. Каждый уровень может содержать определенное количество электронов, которое является результатом электронной конфигурации атома. Электроны заполняют уровни в порядке возрастания энергии, начиная с наименьшего уровня, ближайшего к ядру атома.
На каждом уровне могут находиться подуровни, которые обозначаются буквами s, p, d, f. Каждый подуровень может вмещать разное количество электронов. Например, подуровень s может вмещать до 2 электронов, p - 6 электронов, d - 10 электронов, f - 14 электронов.
Тогда как некоторые уровни могут содержать только один подуровень, другие уровни расширяются и содержат по нескольку подуровней. Это объясняет различные формы периодической таблицы и ее блоков.
К примеру, на первом уровне, который имеет номер 1, есть только один подуровень, обозначаемый как 1s. Он может содержать до 2 электронов. На втором уровне, обозначаемом как 2, есть два подуровня - 2s и 2p, которые могут вместить до 8 электронов в сумме. И так далее.
Важно отметить, что электроны сначала заполняют уровни с наименьшей энергией, а затем переходят на уровни с более высокой энергией. Этот порядок заполнения уровней и подуровней определяется электронной структурой и электронной конфигурацией атома.
| Периоды | Уровни |
|---|---|
| Период 1 | 1s |
| Период 2 | 2s, 2p |
| Период 3 | 3s, 3p |
| Период 4 | 4s, 3d, 4p |
| Период 5 | 5s, 4d, 5p |
| Период 6 | 6s, 4f, 5d, 6p |
| Период 7 | 7s, 5f, 6d, 7p |
Разнообразие элементов и их химические свойства в таблице Менделеева
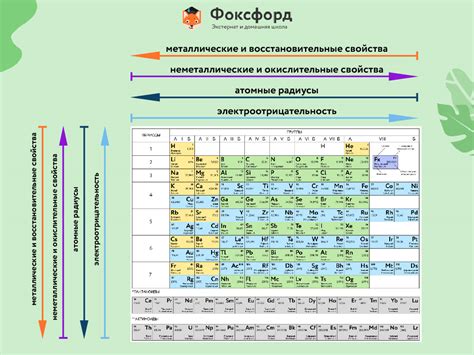
В таблице Менделеева, одном из важнейших достижений химии, химические элементы представлены в порядке возрастания атомного номера и организованы в группы и периоды. Каждый элемент обладает своими характеристиками и уникальными химическими свойствами.
Главное преимущество таблицы Менделеева заключается в том, что она позволяет сгруппировать элементы по их химическим свойствам, что упрощает изучение и понимание взаимодействия между ними. Каждая группа обладает общими химическими свойствами и может содержать элементы разных периодов. Таким образом, таблица Менделеева предоставляет наглядное представление о периодическом законе, который объясняет повторение определенных химических свойств у элементов в определенных интервалах атомных номеров.
- Главная особенность таблицы Менделеева - возможность систематизации элементов в группы и периоды в соответствии с их химическими свойствами.
- Группы элементов объединены в основные и побочные подгруппы в зависимости от внешней электронной конфигурации и химического поведения.
- Периоды представляют собой горизонтальные строки в таблице, обозначающие последовательные уровни энергии, на которых находятся электроны в атомах элементов.
- Расположение элементов в периодической системе отражает их электронную структуру и связано с изменением химических свойств от одного элемента к другому.
- Порядковый номер элемента в таблице Менделеева определяет его атомный номер, который соответствует количеству протонов в ядре атома этого элемента.
Таблица Менделеева является не только удобной учебной моделью, но и важным инструментом для изучения химии и использования во многих научных и промышленных областях. Она позволяет легко определить химические свойства элементов, предсказывать их реактивность и устанавливать связи в химических процессах.
Вопрос-ответ

Где находятся уровни в таблице Менделеева?
Уровни в таблице Менделеева находятся в строчках, которые называются периодами. Всего в таблице 7 периодов, расположенных горизонтально.
Каково расположение уровней в периодической системе?
Уровни в периодической системе расположены вертикально и представлены числами от 1 до 7. Чем выше число, тем выше уровень находится. Таким образом, первый уровень расположен ближе к ядру атома, а последний - наиболее удален от ядра.
Как можно понять, на каком уровне находится элемент в таблице Менделеева?
Для определения уровня элемента в таблице Менделеева можно обратиться к его электронной конфигурации. Последняя цифра в электронной конфигурации указывает на номер уровня. Например, если у элемента в электронной конфигурации стоит число 3, это значит, что он находится на третьем уровне.