Исследование радиоактивных элементов является одной из ключевых задач современной науки. Радиоактивность, оказавшая значительное влияние на многие отрасли промышленности и медицины, является объектом всеобщего интереса, и поэтому важно знать, где искать эти важные радиоактивные изотопы в таблице элементов Менделеева.
Для начала, следует обратить внимание на элементы, обладающие свойствами радиоактивности. Радиоактивные изотопы, по сути, являются "тайными гостями" в таблице. Они могут быть как среди основных, широко известных элементов, так и среди редких "экзотов", представленных в таблице. Поэтому их поиск требует некоторой экспертизы и знания соответствующих свойств элементов.
Расположение различных вариаций химических элементов в периодической системе
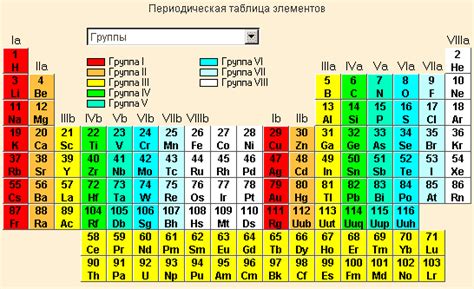
Элементы в периодической системе Д. И. Менделеева представлены в виде различных вариаций с тем или иным количеством нуклонов. Эти вариации, известные как изотопы, представляют собой атомы с одинаковым числом протонов, но различным числом нейтронов в ядре. Однако, чтобы найти информацию о расположении изотопов в таблице Менделеева, следует провести более детальное исследование.
При анализе периодической системы можно заметить, что различные изотопы одного и того же элемента распространены по разным клеткам таблицы Менделеева. Это объясняется их различной массой и электронной конфигурацией, которые влияют на химические и физические свойства элементов. Важно отметить, что изотопы одного элемента обычно имеют похожие химические свойства, но могут отличаться в своей ядерной стабильности и радиоактивности.
- Некоторые изотопы, такие как углерод-12 и углерод-13, могут быть найдены в клетке, относящейся к соответствующему элементу в таблице Менделеева.
- Другие изотопы, такие как углерод-14, являются более редкими и могут быть представлены в специальных уточнениях или примечаниях к таблице Менделеева.
- Иногда изотопы разных элементов представлены вместе, чтобы показать их связь или сходство, например изотопы углерода и кислорода в клетке, относящейся к нитрогену.
Итак, поиск изотопов в таблице Менделеева требует внимательного изучения и восприятия информации, представленной в данном определенном порядке. При этом важно учитывать как клиническую, так и теоретическую значимость каждого изотопа. Знание об изотопах позволяет более глубоко понять химические свойства элементов и их возможное использование в научных и практических целях.
Изучение разнообразия атомов в периодической системе

Периодическая система Менделеева содержит информацию о различных атомах, их символах и атомных номерах. Изучение изотопов, в свою очередь, позволяет понять, что каждый элемент может существовать в разных вариантах, отличающихся количеством нейтронов в ядре атома. Обычно изотопы элементов отличаются в массе, хотя их химические свойства остаются сходными. Изотопы играют важную роль во многих областях науки, включая ядерную физику, геологию, астрономию и медицину.
Поэтому, изучение изотопов представляет собой важное направление исследований и привлекает внимание ученых разных дисциплин. Знание о разновидностях изотопов элементов позволяет более полно понять и описать поведение материи в ее различных состояниях и условиях. В дальнейшем эти знания могут быть применены в создании новых материалов, разработке новых препаратов и исследовании процессов, происходящих в природе и в лабораторных условиях.
Поиск радиоактивных вариаций в необычной графической схеме Менделеева
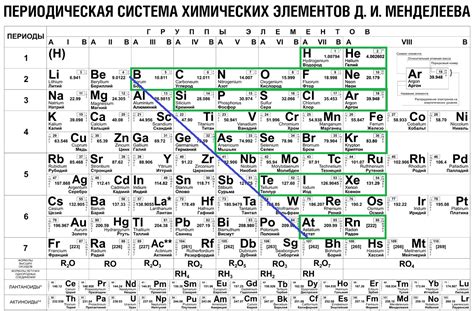
Во внепериодической системе Менделеева можно обнаружить удивительные вариации элементов, называемых изотопами. Изотопы представляют собой беспредельное множество элементов, отражающих необычные формы присутствия и различные массовые числа в пределах одного химического элемента.
Углубляясь в это уникальное разнообразие, мы сможем найти радиоактивные изотопы, которые проявляют интенсивное излучение радиации. Они имеют способность претерпевать изменения в своей структуре на ядерном уровне, что придает им энергию, способную проникать через субстанцию и вызывать химические и физиологические изменения в своей ближайшей окружающей среде.
Чтобы обнаружить эти необычные изотопы, необходимо изучить внепериодическую систему Менделеева, которая представлена в таблице со специфичным набором элементов и их химическими свойствами. Радиоактивные изотопы встречаются в различных угловых точках этой системы, что предоставляет уникальную возможность исследования и анализа их строения и влияния на окружающую среду.
Для лучшего понимания разнообразия радиоактивных изотопов, можно обратиться к таблице Менделеева и сфокусироваться на элементах, обладающих неоднородностью в массовых числах и атомных структурах. Путем изучения этих оригинальных изотопических вариаций, их преимуществ и потенциальных рисков, мы сможем лучше осознать и воздействовать на современные проблемы, связанные с радиоактивностью и ее влиянием на нашу жизнь и экосистему.
| Элемент | Массовое число | Описание |
|---|---|---|
| Уран | 234 | Радиоактивный изотоп, используемый в ядерной энергетике. |
| Радий | 226 | Изотоп сильно радиоактивного элемента, используемый в медицине. |
| Радон | 222 | Изотоп неметалла, являющийся газообразным и проявляющим радиоактивные свойства. |
Распределение изотопов в периодической системе элементов
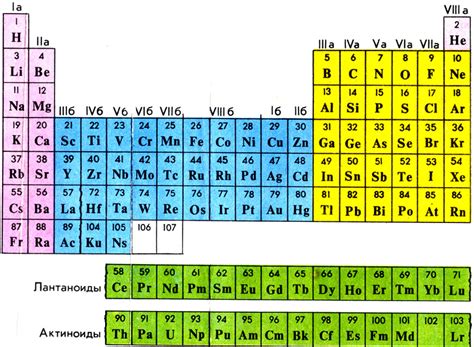
В пределах периодической системы элементов находятся различные варианты атомов, называемые изотопами. Изотопы имеют одинаковое количество протонов, но различное количество нейтронов в атомных ядрах. Распределение изотопов в таблице Менделеева позволяет лучше понять и изучить особенности химических элементов и их свойств.
Изотопы присутствуют практически у всех элементов периодической системы и могут иметь разный процентное содержание в естественных образцах. Универсальная таблица Менделеева предоставляет возможность организовать информацию об изотопах каждого элемента так, чтобы пользователи могли легко найти нужную информацию о конкретном изотопе.
- В каждой ячейке таблицы Менделеева указывается средний атомный массовый номер элемента, который включает в себя как основные, так и наиболее стабильные изотопы данного элемента.
- Символы изотопов могут быть приведены после основного символа элемента, в виде верхнего индекса слева.
- В случае, если изотопы имеют достаточно отличающиеся положения в таблице Менделеева на основе их атомного массового числа, они могут быть отображены в отдельных ячейках.
Информация о распределении изотопов в таблице Менделеева является важной для изучения различных аспектов химии и физики элементов. Она помогает установить связь между структурой атомов и их свойствами, а также позволяет более глубоко понять разнообразие и вариации элементов, которые составляют нашу вселенную.
Ключевые факторы при отыскании изотопов в элементах по периодической системе
В поиске изотопов в периодической системе химических элементов необходимо обратить особое внимание на несколько важных аспектов. Изотопы, являющиеся версиями одного и того же элемента с различным числом нейтронов, можно обнаружить, учитывая определенные факторы, характеризующие структуру и свойства атомов.
Одним из ключевых факторов является атомная масса элемента. Возможность обнаружить изотопы можно предсказать, исходя из значений атомной массы элемента. Большинство элементов имеют несколько стабильных изотопов, и частота их встречаемости может различаться.
Еще одним важным аспектом является энергетический уровень электронов. Изотопы могут иметь различный энергетический уровень электронной оболочки и, следовательно, взаимодействие с другими атомами и молекулами может происходить по-разному. Это может привести к различным физическим и химическим свойствам изотопов.
Также стоит учитывать периодическую закономерность химических свойств элементов. Она позволяет предсказать, на основании положения элемента в таблице Менделеева, наличие изотопов определенного типа и их свойства. Например, изотопы элементов одной группы или периода имеют сходные свойства.
Вопрос-ответ

Какие элементы в таблице Менделеева являются изотопами?
В таблице Менделеева все элементы могут иметь изотопы. Изотопы - это атомы одного и того же элемента с разным числом нейтронов, но с одинаковым числом протонов в ядре. Некоторые изотопы встречаются естественно, а некоторые могут быть созданы искусственно.
Как можно найти изотопы в таблице Менделеева?
В таблице Менделеева изотопы обозначаются с помощью числа, которое указывается после символа элемента. Например, самый распространенный и стабильный изотоп углерода имеет атомный номер 6 и обозначается как С-12. Однако, встречаются и другие изотопы углерода, такие как С-13 и С-14, которые имеют разное число нейтронов в ядре.
Какие элементы в таблице Менделеева имеют больше одного изотопа?
Многие элементы в таблице Менделеева имеют несколько изотопов. Например, у водорода есть два стабильных изотопа: дейтерий (H-2) и тритий (H-3). У кислорода также есть три стабильных изотопа: кислород-16 (O-16), кислород-17 (O-17) и кислород-18 (O-18). Более тяжелые элементы, такие как уран или плутоний, имеют множество изотопов, как стабильных, так и нестабильных.