Химические реакции – большая и сложная область науки, в которой открытое множество неразгаданных тайн и открытий. Одной из фундаментальных концепций в химии является скорость химической реакции, которая определяется несколькими ключевыми факторами. Понимание этих факторов играет важную роль в практическом аспекте нашей жизни, от производства промышленных товаров до повседневных химических процессов.
Для того чтобы более глубоко понять процессы, лежащие в основе химических реакций, необходимо изучение влияния различных факторов на их скорость. Скорость реакции может быть ускорена или замедлена, именно поэтому изучение и понимание факторов, которые влияют на скорость, направлено на установление причин этих изменений и оптимизацию химических процессов.
Один из ключевых факторов, оказывающих влияние на скорость химической реакции, это концентрация реагентов. Концентрация реагентов определяет количество частиц в единице объема и тем самым контролирует частоту соударений между молекулами. Большая концентрация реагентов приводит к более частым соударениям, что увеличивает вероятность столкновений и, следовательно, скорость реакции. В то же время, низкая концентрация реагентов приводит к режиму реакции с более низкой скоростью и уменьшенной вероятностью соударений.
Еще одним фактором, оказывающим влияние на скорость реакции, является температура. Теплота, добавляемая к системе, активирует молекулы, увеличивая их энергию и приводя к более эффективным соударениям. Высокая температура приводит к повышению скорости реакции благодаря увеличению количества молекул с достаточной энергией для прохождения активационного барьера. Низкая температура, напротив, приводит к замедлению реакции из-за недостаточной энергии для преодоления барьера.
Физические воздействия на химическую реакцию

Помимо химических факторов, таких как концентрация реагентов и температура, от которых зависит скорость химической реакции, существуют также физические факторы, которые оказывают влияние на процесс химической превращения веществ.
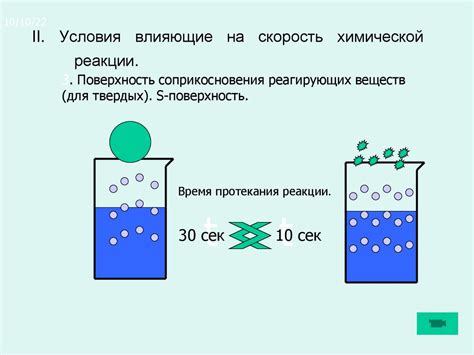
Один из таких факторов - поверхность контакта реагентов. Чем больше площадь взаимодействия между реагентами, тем эффективнее протекает химическая реакция. Для увеличения поверхности контакта могут применяться различные методы, например, диспергирование твердого реагента или использование катализаторов.
Еще одним важным фактором является агитация или перемешивание реагентов. Благодаря перемешиванию молекулярные взаимодействия становятся более интенсивными, что способствует увеличению вероятности столкновений реагентов и, соответственно, ускоряет химическую реакцию. В процессе перемешивания также происходит равномерное распределение теплоты, что способствует поддержанию постоянной температуры.
Еще одним физическим фактором, влияющим на химическую реакцию, является давление. В некоторых случаях повышение давления может увеличить скорость реакции, так как оно способствует сближению молекул реагентов и, следовательно, увеличивает вероятность их столкновений. Однако в других случаях давление может оказывать противоположное воздействие и замедлять реакцию.
| Физические факторы | Влияние на химическую реакцию |
|---|---|
| Поверхность контакта | Увеличение поверхности контакта реагентов способствует ускорению химической реакции |
| Агитация или перемешивание | Перемешивание реагентов увеличивает вероятность столкновений и скорость реакции |
| Давление | Давление может как увеличивать, так и замедлять химическую реакцию в зависимости от условий |
Температура: важное условие для скорости реакции
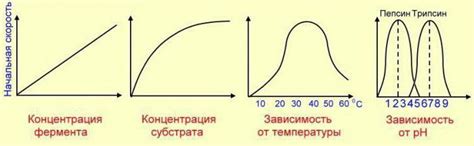
Изменение температуры влияет на скорость реакции посредством изменения энергии активации – минимальной энергии, необходимой для того, чтобы молекулы реагирующих веществ могли перейти в продукты реакции. Повышение температуры увеличивает среднюю кинетическую энергию молекул, что способствует более частым и успешным столкновениям, приводящим к образованию продуктов реакции. Это может привести к ускорению реакции, увеличению ее скорости.
Кроме того, изменение температуры может изменить скорость и направленность реакции путем изменения равновесия между реагентами и продуктами. Некоторые реакции могут быть эндотермическими, то есть поглощать тепло, в то время как другие реакции являются экзотермическими, то есть выделяют тепло. При повышении температуры эндотермические реакции становятся более благоприятными, так как они получают дополнительную энергию от окружающей среды. В то же время экзотермические реакции могут замедляться при повышении температуры, так как более высокая тепловая энергия может снижать стабильность продуктов реакции.
Температура является важным фактором, который необходимо контролировать и учитывать при проведении химических реакций. Она может влиять на скорость реакции, на выбор продуктов реакции и на равновесие между реагентами и продуктами. Понимание и управление температурными условиями позволяет оптимизировать процессы химических превращений и достичь желаемых результатов.
Связь концентрации реагентов с кинетической константой

Концентрация реагентов можно определить как количество вещества, содержащегося в единице объема реакционной смеси. Увеличение концентрации реагентов обычно приводит к увеличению скорости реакции, поскольку большее количество частиц реагентов создает больше возможностей для взаимодействия, увеличивая вероятность прохождения участков переходного состояния и, соответственно, скорость реакции.
Кинетическая константа обычно представляет собой безразмерное число, которое связывает концентрации реагентов с скоростью реакции. Она определяется экспериментально и является характеристикой каждой конкретной реакции. Используя математическую формулу, можно определить связь между концентрацией реагентов и кинетической константой.
При исследовании влияния концентрации реагентов на константу скорости химической реакции, важно учитывать соблюдение закона действующих масс. Этот закон утверждает, что скорость химической реакции пропорциональна произведению концентраций реагентов, возведенных в степени, равную их соответствующим коэффициентам в уравнении реакции.
Таким образом, концентрация реагентов играет важную роль в определении константы скорости химической реакции. Увеличение концентрации реагентов обычно приводит к увеличению скорости реакции, а изменение концентрации может влиять на значение кинетической константы.
Поверхность контакта: роль катализаторов в процессе

Один из факторов, влияющих на скорость химической реакции, заключается в поверхности контакта между реагирующими веществами. Ключевую роль в этом процессе играют катализаторы, оказывающие существенное влияние на конечный результат.
Поверхность контакта представляет собой область, где молекулы одного вещества вступают во взаимодействие с молекулами другого. Чем больше поверхность контакта, тем больше возможностей для реагирования между веществами и, следовательно, тем выше скорость реакции.
Однако реакция находится под влиянием различных препятствий, среди которых могут быть невысокие температуры и ограниченное время реакции. В таких случаях катализаторы выступают в роли посредников, снижая энергетический барьер для реакции и ускоряя процесс. Они предоставляют дополнительную поверхность контакта между веществами, на которой молекулы могут взаимодействовать и превращаться в конечный продукт реакции.
- Роль катализаторов в процессе реакции
- Увеличение поверхности контакта
- Энергетический барьер и его преодоление
- Катализаторы как посредники
Давление: сила сопротивления и влияние на скорость химических реакций

В данном разделе мы рассмотрим роль давления в химических реакциях и его влияние на скорость и ход процессов. Обратим внимание на факторы, связанные с изменением давления: изменение количества газа, изменение объема реакционной смеси и сдвиг равновесия.
Сила сопротивления: одним из ключевых факторов, влияющих на ход химических реакций, является давление. Давление определяется количеством газа, находящегося в замкнутой системе, и объемом этой системы. В зависимости от условий, изменение давления может вызывать сдвиг равновесия, что приводит к изменению скорости реакции.
Влияние на скорость реакции: изменение давления оказывает влияние как на быстроту, так и на направленность реакции. При увеличении давления в системе с реагентами, молекулы газа оказывают большую силу на стенки сосуда, что обуславливает увеличение частоты столкновений и активацию реакции, тем самым увеличивая ее скорость. В свою очередь, при снижении давления происходит увеличение объема системы, что ведет к снижению концентрации реагентов и, соответственно, замедлению химической реакции.
Изменение объема: изменение давления связано с изменением объема реакционной смеси. Если давление увеличивается, объем сокращается, а при снижении давления – объем увеличивается. Эти изменения могут вызывать сдвиг равновесия, приводящий к изменению концентраций реакционных смесей и, как следствие, изменению скорости реакции.
Сдвиг равновесия: изменение давления может привести к сдвигу равновесия химической реакции. Если реакция происходит с увеличением объема, то равновесие сдвигается в сторону увеличения количества вещества. В случае сокращения объема системы, равновесие сдвигается в противоположную сторону. Этот сдвиг равновесия ведет к изменению концентраций реагентов и продуктов, что непосредственно влияет на скорость химической реакции.
Таким образом, давление способно изменять скорость и условия протекания химических реакций путем сдвига равновесия и изменения объема реакционной смеси. Изучение данного фактора позволяет глубже понять взаимосвязь между составом системы и скоростью процесса.
Химические свойства веществ и скорость химической реакции
Свойства химических веществ играют важную роль в определении скорости химических реакций. Понимание химических свойств веществ позволяет установить взаимодействия между ними и определить, какие факторы влияют на скорость реакции.
- Структура молекул. Форма и связи внутри молекулы могут влиять на вероятность коллизий между реагентами. Молекулы с более сложной структурой или сильными химическими связями могут иметь более низкую скорость реакции.
- Реакционная активность. Некоторые вещества обладают высокой реакционной активностью, что позволяет им участвовать в реакциях с большей скоростью. Это может быть связано с наличием активных функциональных групп или возможностью образования стабильных промежуточных комплексов.
- Растворимость. Растворимость вещества в реакционной среде может влиять на скорость реакции. Более растворимые вещества имеют более высокую концентрацию реагентов, что способствует более частым столкновениям и увеличивает скорость реакции.
- Температура. Повышение температуры обычно приводит к увеличению скорости реакции. Это объясняется более энергичными коллизиями между молекулами, что способствует частому образованию активированных комплексов и, следовательно, увеличению вероятности реакции.
- Концентрация реагентов. Увеличение концентрации реагентов повышает вероятность частых столкновений и, соответственно, увеличивает скорость реакции. Более высокие концентрации обычно приводят к более быстрой реакции.
- Катализаторы. Присутствие катализатора может ускорить химическую реакцию, позволяя ей протекать при более низких энергиях активации. Катализаторы облегчают реакцию, участвуя в промежуточных стадиях, и могут быть использованы повторно.
Таким образом, химические свойства веществ оказывают значительное влияние на скорость химической реакции. Понимание этих свойств помогает оценить, какие факторы могут повлиять на скорость реакции и как их оптимизировать для достижения желаемых результатов.
Чувствительность реакции к pH-уровню

По мере изменения pH-уровня, реакция может проявлять различные свойства и способность происходить с разными скоростями. Это может быть вызвано изменением ионизации реагентов, дисоциацией веществ или преобладанием определенных химических форм веществ при определенных значениях pH-уровня. Реакции, которые проявляют чувствительность к pH-уровню, могут быть как кислотно-основными, так и не иметь ярко выраженного кислотно-основного характера.
В некоторых случаях даже незначительные изменения pH-уровня могут привести к значительному изменению скорости реакции. Например, может происходить обратимое изменение конформации белков при изменении pH, что влияет на активность ферментов, а следовательно, и на скорость химических превращений, которые они катализируют.
Чувствительность реакции к pH может быть обусловлена ионами водорода, которые могут изменять активность катализаторов и скорость реакции. Иногда изменение pH-уровня может привести к изменению заряда на поверхности катализатора, что может повлиять на процесс адсорбции реагентов и образования промежуточных продуктов реакции.
Кроме того, важно учитывать, что pH-уровень может влиять на растворимость реагентов, и, следовательно, на доступность молекул к взаимодействию и реакциям. Изменение pH может также изменить равновесие между различными формами вещества, что может сказаться на его активности и способности участвовать в химических реакциях.
Таким образом, фактор pH-уровня может быть решающим для определения скорости и процесса химической реакции. Учет этого фактора очень важен в понимании и прогнозировании химических превращений, а также в разработке и оптимизации катализаторов и условий реакций.
Окислительно-восстановительные процессы и скорость химической реакции
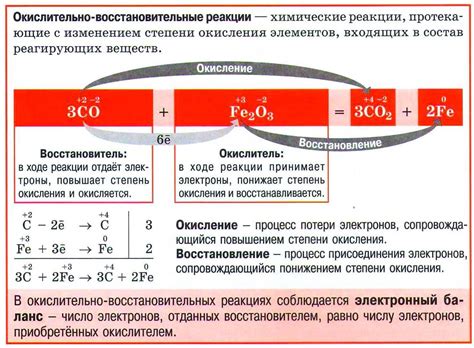
В окислительно-восстановительных реакциях активная роль играют оксиданты и восстановители. Оксидантами могут быть соединения, которые легко отдают электроны и обладают высокой электроотрицательностью, например, кислород, хлор, перманганаты. Восстановителями, наоборот, являются вещества, способные принимать электроны и обладающие низкой электроотрицательностью, например, водород, металлы, сера.
| Оксиданты | Восстановители |
|---|---|
| Кислород | Водород |
| Хлор | Металлы |
| Перманганаты | Сера |
Скорость реакции окисления определяется различными факторами, включая концентрацию оксиданта и восстановителя, их природу и физическое состояние, температуру, рН среды и наличие катализаторов. Например, повышение концентрации оксиданта или восстановителя увеличивает количество активных частиц, что способствует увеличению частоты столкновений и, следовательно, ускоряет реакцию. Также температура оказывает важное влияние на скорость окислительно-восстановительных процессов – с повышением температуры увеличивается кинетическая энергия частиц и вероятность эффективного столкновения.
Окислительно-восстановительные процессы широко применяются в различных областях науки и техники. Они играют значительную роль в химической промышленности, а также в биологических и экологических процессах. Понимание и управление скоростью этих процессов является важным элементом в разработке новых материалов, катализаторов и методов синтеза в химии, а также в практике аналитической химии и окружающей среды.
Особенности реагирования в различных физических условиях

Физические условия, такие как температура, давление и концентрация реагентов, могут оказывать существенное влияние на скорость и направление химической реакции. Температура является одним из самых важных факторов, так как влияет на кинетику молекулярного движения и энергетический барьер реакции. Повышение температуры обычно приводит к увеличению скорости химической реакции, так как частицы двигаются быстрее и имеют больше энергии для преодоления энергетического барьера.
Давление также может влиять на химическую реакцию, особенно при газообразных системах. Повышение давления обычно увеличивает концентрацию газовых частиц, что может увеличить частоту их столкновений и, следовательно, увеличить скорость реакции.
Концентрация реагентов является еще одним фактором, влияющим на скорость химической реакции. Повышение концентрации реагентов увеличивает вероятность их столкновения, что приводит к увеличению количества эффективных столкновений и, в конечном счете, к повышению скорости реакции.
Таким образом, физические условия играют критическую роль в определении скорости и направления химической реакции. Понимание и учет этих условий позволяет контролировать реакцию и оптимизировать процессы в химической промышленности и других областях, где химические реакции являются важными.
Влияние солнечной радиации на скорость химической реакции

Солнечная радиация представляет собой энергию, которую излучает Солнце. Ее основные компоненты включают видимый свет, ультрафиолетовое и инфракрасное излучение. Воздействуя на вещества и реагенты химической системы, солнечная радиация может вызывать изменения в их строении и свойствах, что приводит к изменению скорости реакции.
Возможные механизмы влияния солнечной радиации на скорость реакции включают:
- Поглощение энергии. Солнечная радиация может быть поглощена реагентами, что приводит к повышению температуры системы. При этом активируются молекулы реагентов, что способствует повышению их коллизионной энергии и, соответственно, скорости реакции.
- Инициация реакций. Ультрафиолетовое излучение может вызывать развитие цепных реакций, активируя определенные молекулы. Это может приводить к ускорению или замедлению реакции в зависимости от характера происходящих процессов.
- Фотодиссоциация. Солнечная радиация может ломать или разрывать химические связи в молекулах реагентов. Это может способствовать образованию новых реактивных частиц и их дальнейшим химическим взаимодействиям, что вызывает изменение скорости химического процесса.
Таким образом, солнечная радиация играет важную роль в определении скорости химической реакции. Ее воздействие может быть сложно предсказать и зависит от ряда факторов, включая спектр излучения, характер реагентов и условия окружающей среды. Изучение этого вопроса позволяет лучше понять механизмы химических реакций и их взаимодействие с окружающей средой.
Вопрос-ответ

Какие факторы влияют на константу скорости химической реакции?
Факторы, которые могут влиять на константу скорости химической реакции, включают в себя температуру, концентрацию реагентов, поверхность контакта, наличие катализаторов и давление.
Почему температура является фактором, влияющим на константу скорости реакции?
Температура влияет на константу скорости реакции потому, что при повышении температуры частицы реагентов обладают большей энергией и двигаются более быстро, что способствует частому столкновению реагентов и увеличению скорости реакции.
Как концентрация реагентов влияет на константу скорости химической реакции?
Концентрация реагентов имеет важное значение для скорости реакции. Повышение концентрации реагентов увеличивает вероятность их столкновения и, соответственно, увеличивает скорость реакции. Увеличение концентрации реагентов приводит к увеличению числа частых столкновений и, в результате, ускоряет химическую реакцию.
В чем заключается влияние поверхности контакта реагентов на константу скорости химической реакции?
Поверхность контакта реагентов является фактором, определяющим скорость химической реакции. Большая поверхность контакта обеспечивает большую площадь для столкновений реагентов и ускоряет реакцию. Увеличение поверхности контакта может быть достигнуто, например, раздроблением твердых реагентов или использованием катализаторов.
Какое влияние оказывает наличие катализаторов на константу скорости химической реакции?
Катализаторы влияют на константу скорости химической реакции, ускоряя процесс без изменения концентрации реагентов. Катализаторы снижают энергию активации реакции, что делает процесс более вероятным и ускоряет химическую реакцию.



