Когда мы рассматриваем процесс растворения твёрдых веществ в воде, необходимо учесть разнообразие факторов, которые оказывают влияние на этот процесс. Вода, являющаяся универсальным растворителем, обладает уникальными свойствами, которые позволяют ей смешиваться со множеством различных веществ. Основные причины растворения твёрдых веществ можно назвать факторами, которые определяют способность вещества смешиваться с водой.
Адгезия – это ключевой фактор, влияющий на растворимость твёрдых веществ в воде. Адгезия обусловлена взаимодействием между молекулами вещества и молекулами воды. Такое взаимодействие устанавливает прочную связь между веществом и водой и способствует успешному процессу растворения. Силы, обусловливающие адгезию, могут быть различными – от электрических притяжений до взаимодействий на основе полярности молекул. Чем больше адгезивная сила, тем лучше будет растворяющая способность воды.
Результатом взаимодействия адгезии является гидратационная оболочка, которая формируется вокруг твёрдого вещества, находящегося в воде. Эта оболочка окружает вещество и защищает его от обратного перемещения в растворе. Таким образом, гидратационная оболочка обеспечивает стабильность растворенного вещества в воде и позволяет растворению происходить более эффективно.
Важные факторы, воздействующие на способность твердых веществ растворяться в воде
Одним из основных факторов, влияющих на растворимость твердых веществ в воде, является температура. С повышением температуры, обычно растворимость твердых веществ увеличивается, так как возрастает энергия частиц, способствующая разрушению связей в кристаллической решетке и формированию раствора. Таким образом, при повышении температуры предоставляется больше энергии для преодоления сил притяжения между частицами вещества, что способствует их растворению.
Вторым важным фактором, влияющим на растворимость, является размер частиц твердого вещества. Более мелкие частицы имеют большую поверхность контакта с водой, что увеличивает возможность взаимодействия частиц вещества и молекул воды, делая растворение эффективнее. Следовательно, более мелкие частицы имеют более высокую растворимость в воде по сравнению с крупными.
Кроме того, в растворимость твердых веществ в воде влияет также химический состав вещества и наличие растворителей, способствующих его растворению. Некоторые вещества, такие как соли и кислоты, обладают положительно заряженными и отрицательно заряженными ионами, которые могут притягиваться к положительно и отрицательно заряженным молекулам воды. Это позволяет им растворяться в воде. В то же время, наличие растворителей с аналогичным химическим составом может улучшить растворимость этих веществ.
| Фактор | Влияние на растворимость |
|---|---|
| Температура | Увеличение температуры способствует увеличению растворимости |
| Размер частиц | Меньшие частицы обычно имеют более высокую растворимость |
| Химический состав и наличие растворителей | Химический состав вещества и наличие совместимых растворителей могут улучшить его растворимость |
Взаимосвязь растворимости с изменением температуры
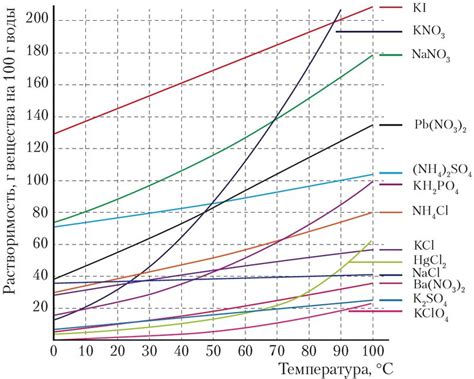
В данном разделе рассмотрим, как изменение температуры оказывает влияние на способность твердых веществ растворяться в воде. Этот фактор очень важен и может оказывать существенное воздействие на процесс растворения.
Согласно нашим наблюдениям, с повышением температуры обычно наблюдается увеличение растворимости различных твердых веществ в воде. В таких случаях, можно сказать, что теплота способна стимулировать процесс растворения.
Более подробное рассмотрение этой зависимости позволяет утверждать, что повышение температуры приводит к увеличению энергии молекул растворителя, что в свою очередь усиливает их коллизии с молекулами твердого вещества. Такое взаимодействие существенно облегчает проникновение растворителя в твердое вещество и способствует его растворению.
Следует отметить, что зависимость растворимости от температуры не является общей для всех твердых веществ. В некоторых случаях, повышение температуры может вызывать обратный эффект и приводить к снижению растворимости. Это связано с особенностями специфических химических взаимодействий между растворителем и твердым веществом.
Важность растворимости в проведении химических реакций

Растворимость играет значительную роль в процессе химических реакций, определяя возможность взаимодействия твердых веществ с другими веществами в растворах. Этот фактор существенно влияет на эффективность химических процессов и способность веществ взаимодействовать друг с другом.
Во-первых, растворимость позволяет смешивать различные вещества в растворах, образуя гомогенные смеси. Это дает возможность обеспечить более равномерное распределение реагентов в реакционной среде, что в свою очередь способствует более эффективным реакционным процессам.
Во-вторых, растворимость влияет на скорость химических реакций. Чем лучше твердое вещество растворяется в реакционной среде, тем больше поверхности вещества доступно для взаимодействия с другими частями реакционной смеси. Это повышает вероятность достижения эффективных столкновений и ускоряет протекание реакции.
Кроме того, растворимость окажет влияние на конечную концентрацию реагентов и продуктов в растворе после завершения реакции. Она может ограничивать количество веществ, которые могут раствориться в данной реакционной среде, и влиять на итоговые количественные характеристики химического процесса.
- Растворимость может обеспечить однородное распределение реагентов в среде.
- Улучшение скорости реакций за счет увеличения доступной поверхности вещества.
- Регулировка конечной концентрации компонентов реакции.
Таким образом, растворимость твердых веществ является важным фактором, который следует учитывать при проведении химических реакций. Она влияет на эффективность реакционных процессов, их скорость и итоговую концентрацию веществ в реакционной среде.
Влияние размера частиц на способность твердых веществ растворяться в воде
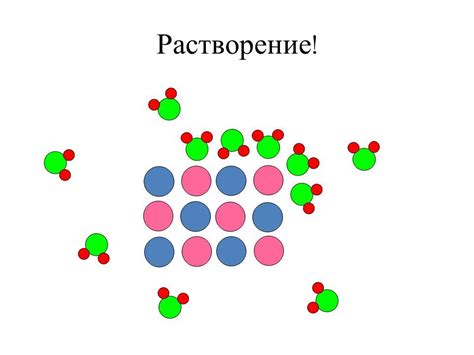
Один из важных факторов, оказывающих влияние на растворимость твердых веществ в воде, это размер их частиц. От размера частиц зависит способность вещества образовывать растворы и взаимодействовать с молекулами воды.
Если частицы вещества мельче, то их поверхность становится значительно больше по сравнению с крупными частицами. Благодаря этому, более мелкие частицы обладают большей поверхностной активностью и имеют больше точек контакта с молекулами воды. В результате этого, мелкие частицы имеют более высокую растворимость в воде, чем крупные.
Следует отметить, что при малых размерах частиц происходит увеличение интенсивности молекулярного движения, что способствует усилению взаимодействия между частицами вещества и молекулами воды. Это приводит к более эффективному растворению мелких частиц и более быстрому достижению насыщенности раствора.
Распад ионных соединений при диссоциации
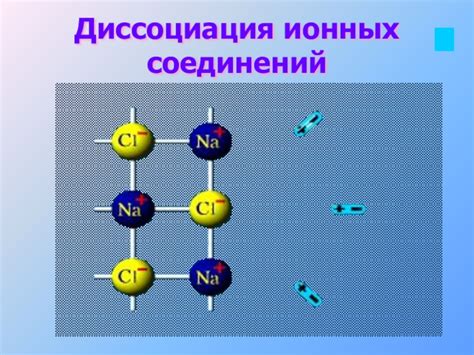
Разложение ионных соединений в процессе растворения представляет собой фундаментальную составляющую в интеракции между твердыми веществами и водой. В этом процессе ионные соединения разлагаются на ионы, которые в итоге образуют гидратные или сольватные оболочки вокруг себя. Такая диссоциация позволяет твердым веществам стать растворимыми и взаимодействовать с молекулами воды, что способствует их полному или частичному растворению.
В процессе диссоциации ионные соединения разделяются на положительно и отрицательно заряженные ионы. Положительные ионы, такие как катионы металла, образуются благодаря отрыву электронов от исходного соединения, в то время как отрицательно заряженные ионы, такие как анионы, формируются путем присоединения этих электронов к молекулам воды. Такое разделение облегчает перемещение ионов в воде и содействует их дальнейшему распределению по всему объему раствора.
Распад ионных соединений при растворении играет важную роль в различных химических и биологических процессах. Он способствует образованию электролитических растворов, где положительно и отрицательно заряженные ионы могут участвовать в электрических реакциях. Кроме того, этот процесс существенно влияет на понимание общих свойств растворов и способствует практическому применению растворов в различных областях науки и промышленности.
Взаимодействие твердого вещества с водой: значение полярности

Вода, являясь полярным соединением, имеет дипольные молекулы, где электроотрицательный кислород притягивает электроноотрицательные водороды соседних молекул. Это создает положительные и отрицательные поля внутри молекулы воды, обусловливающие ее полярность.
Твердые вещества, обладающие полярностью, часто имеют в молекулах полярные связи или наличие атомов, обладающих значительной разностью в электронной плотности. Такие вещества обладают способностью вступать в химические реакции с водой и образовывать гидраты, что приводит к их хорошей растворимости.
В то время как твердые вещества, не обладающие полярностью, могут иметь слабую взаимосвязь с молекулами воды из-за отсутствия полюсов в своей структуре. Такие вещества имеют малую растворимость в воде и могут оставаться в осадке или образовывать инсолюбильные соединения.
| Факторы взаимодействия с водой: | Роль полярности |
|---|---|
| Наличие полярных связей | Обуславливают хорошую растворимость в воде |
| Отсутствие полюсов | Вещества имеют малую растворимость |
| Взаимодействие и образование гидратов | Способствуют образованию растворов |
Влияние давления на растворимость
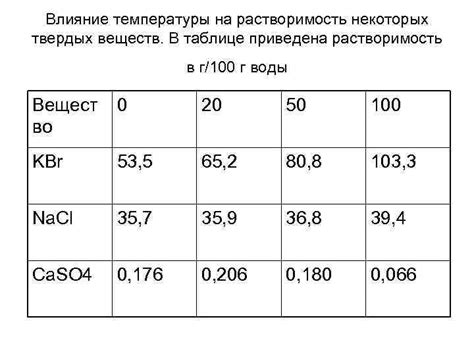
В данном разделе будет рассмотрено влияние давления на способность твердых веществ растворяться в воде. Обычно мы уделяем большее внимание другим факторам, таким как температура и концентрация, но давление также оказывает своё воздействие на процесс растворения. Давление играет важную роль в регулировании растворимости веществ и может оказывать как положительное, так и отрицательное воздействие.
Воздействие давления на растворимость твердых веществ в воде может проявляться различными способами. Во-первых, повышение давления может увеличить растворимость вещества, что означает, что больше вещества сможет раствориться в данном количестве воды. Это связано с тем, что повышенное давление способствует увеличению количества коллизий между молекулами вещества и молекулами воды, что облегчает процесс растворения.
Во-вторых, некоторые вещества могут переходить в другие формы под влиянием давления, что в свою очередь может повлиять на их растворимость. Например, увеличение давления может привести к переходу некоторых твердых веществ в аморфные состояния, что может увеличить их доступность для взаимодействия с молекулами воды и, как следствие, повысить растворимость.
Однако есть и противоположная сторона - некоторые вещества могут иметь обратную зависимость между давлением и растворимостью. Возможно, повышение давления вызовет обратную реакцию и приведет к образованию твердого осадка или обратному процессу кристаллизации.
| Преимущества повышенного давления: | Недостатки повышенного давления: |
|---|---|
| Повышение растворимости | Образование осадка |
| Увеличение количества коллизий между молекулами | Обратная реакция и кристаллизация |
Таким образом, давление является одним из важных факторов, влияющих на растворимость твердых веществ в воде. Оно может повышать или понижать растворимость в зависимости от свойств и характеристик каждого конкретного вещества. Понимание воздействия давления помогает нам лучше осознать причины различных процессов растворения и способствует более глубокому изучению данной темы.
Растворение солей и кислот: роль ионного обмена
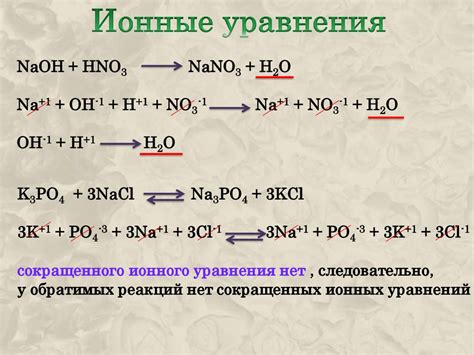
В процессе растворения солей и кислот ионы вещества, составляющие их структуру, вступают во взаимодействие с водными молекулами. Вода, будучи полярным молекулой, способна образовывать водородные связи с различными ионами, что обеспечивает энергетически выгодные условия для разрушения и создания химических связей. Полученные при этом ионы разделяются или организуют связи с другими ионами в растворе, образуя новые химические соединения.
Результатом ионного обмена в растворе солей и кислот является изменение его электрической проводимости и pH-уровня. Ионные реакции, происходящие между растворителем и веществами, влияют на реакционную способность среды и способность этих веществ действовать на другие реагенты. Это значит, что ионный обмен в растворе является причиной изменения химических свойств и характеристик растворенных веществ.
Роль полюсности молекул в растворимости органических веществ в воде

Полюсные молекулы, также известные как полярные соединения, содержат полярные связи или функциональные группы, которые имеют различные электроотрицательности. Это создает разницу в зарядах на концах молекулы, делая ее положительно и отрицательно заряженными участками. Вода, в свою очередь, обладает дипольными молекулами, где положительный и отрицательный заряды находятся на разных концах.
| Причины растворимости органических веществ в воде, связанные с полюсностью молекул: | |
|---|---|
| 1. Образование водородных связей: | Полярные группы органического соединения могут вступать во взаимодействие с водными молекулами через образование водородных связей. Эти слабые, но стабильные связи позволяют частицам встраиваться в водный раствор и образовывать устойчивые растворы. |
| 2. Соляция: | Полярные соединения могут диссоциировать в воде, образуя ионные растворы. Это происходит благодаря взаимодействию положительно и отрицательно заряженных участков молекулы с водными ионами. Такие растворы являются полностью растворимыми в воде. |
| 3. Дисперсия: | Даже неполярные органические вещества, не обладающие заряженными группами, могут быть некоторым образом растворены в воде благодаря эффекту дисперсии. Этот процесс основан на образовании водородных связей между различными органическими и водными молекулами, а также на взаимодействии с дипольными молекулами воды. |
Таким образом, полюсность молекул органических веществ играет важную роль в их растворимости в воде. Взаимодействие положительно и отрицательно заряженных участков молекул органических соединений с полярными молекулами воды позволяет создавать стабильные растворы, обладающие существенными химическими и физическими свойствами.
Влияние растворимости на процессы абсорбции и диффузии в природе и на практике
В данном разделе мы рассмотрим важное влияние растворимости на процессы абсорбции и диффузии, как в природных условиях, так и в практических приложениях. Обратимся к общей идее этого взаимосвязанного явления, избегая использования специальных определений и терминологии.
Растворимость кристаллических веществ является ключевым фактором во многих процессах, которые происходят на Земле. Когда вещество растворяется, оно переходит из твердого состояния в жидкое, проникая среду, в которую оно было добавлено. Подобное явление можно встретить в природе, например, в процессе образования водных растворов минералов в почве или в океане. Однако влияние растворимости не ограничивается только природными процессами, оно также играет важную роль в различных практических областях.
Процессы абсорбции и диффузии имеют тесную связь с растворимостью веществ в среде. Абсорбция представляет собой проникновение вещества в другую среду, будь то газ, жидкость или твердое вещество. Растворимость определяет, насколько эффективно вещество может раствориться в данной среде и проникнуть в нее. Диффузия, в свою очередь, является распространением молекул вещества по среде, и здесь также играет роль растворимость временного пребывания молекул в данной среде.
Практическое применение растворимости простирается на множество областей, таких как медицина, химия и пищевая промышленность. Например, растворимость лекарственных веществ в организме имеет прямое влияние на скорость и степень их усвоения органами и тканями, что является одной из ключевых характеристик эффективности лекарственного препарата. В химии, знание растворимости разных веществ позволяет контролировать реакции, происходящие в растворах, и разрабатывать новые материалы с желаемыми свойствами. В пищевой промышленности необходимо учитывать растворимость различных компонентов, чтобы добиться равномерного распределения пищевых добавок и достичь определенного вкуса или текстуры продукта.
Вопрос-ответ

Какие факторы влияют на растворимость твердых веществ в воде?
На растворимость твердых веществ в воде влияют различные факторы, включая температуру, давление, природу вещества и концентрацию раствора. Также важную роль играют силы взаимодействия между молекулами вещества и молекулами воды.
Почему температура влияет на растворимость твердых веществ в воде?
Температура имеет большое значение для растворимости твердых веществ в воде. Обычно, с повышением температуры растворимость твердых веществ увеличивается. Это происходит из-за того, что при повышении температуры энергия молекул воды увеличивается, что способствует разрушению сил притяжения между молекулами твердого вещества и позволяет лучше проникать молекулам воды внутрь сетки кристаллической структуры, тем самым расщепляя твердое вещество и превращая его в ионы, способные растворяться в воде.
Скажите, пожалуйста, как давление воздействует на растворимость твердых веществ в воде?
Давление также имеет некоторое влияние на растворимость твердых веществ в воде, хотя это влияние незначительное. В общем, с увеличением давления растворимость твердых веществ в воде увеличивается. Это связано с тем, что под давлением объем воды становится меньше, что способствует увеличению концентрации раствора и ускоряет процесс растворения твердых веществ.
Почему природа вещества имеет значение для их растворимости в воде?
Природа твердого вещества существенно влияет на его растворимость в воде. Некоторые вещества обладают ионным характером и легко расщепляются на положительно и отрицательно заряженные ионы при контакте с водой, таким образом, быстро растворяются. Другие вещества могут образовывать молекулярные соединения с водой, что также способствует их растворимости. Однако есть и такие вещества, которые плохо растворяются в воде из-за отсутствия необходимых химических свойств для взаимодействия с молекулами воды.
Почему некоторые твердые вещества растворяются в воде, а другие нет?
Растворимость твердых веществ в воде зависит от их химического строения и таких факторов, как полярность молекулы, межмолекулярные взаимодействия и температура. Вещества с полярными молекулами часто растворяются в воде, так как они могут образовывать водородные связи с молекулами воды. Некоторые вещества имеют ионную структуру, и их ионы могут образовывать гидратированные оболочки вокруг себя, что способствует растворению. Однако, неполярные вещества, не обладающие подходящей химической структурой для образования взаимодействий с водой, обычно плохо растворимы.
Какую роль играет температура в процессе растворения твердых веществ в воде?
Температура является одним из ключевых факторов, влияющих на растворимость твердых веществ в воде. Обычно, при повышении температуры, растворимость твердых веществ увеличивается. Это связано с увеличением кинетической энергии молекул воды, что способствует преодолению сил притяжения между частицами вещества и улучшает их взаимодействие с молекулами воды. Однако, есть и исключения, например, некоторые эндотермические реакции растворения твердых веществ, при которых растворимость снижается с повышением температуры.