Когда мы обращаем внимание на окружающий мир, мы видим, что большинство веществ, с которыми мы взаимодействуем, разлагаются или растворяются в воде. Этот процесс позволяет нам получать новые вещества, а также понимать химическую природу многих соединений.
В химической науке такие процессы называются диссоциацией, когда вещество разлагается на более простые компоненты, или растворением, когда вещество вступает в реакцию с водой и образует единый раствор. Происходит это всегда при участии кислот, щелочей и солей, которые обладают свойством распадаться на ионы.
Ионы - это заряженные атомы или группы атомов, которые могут объединяться в разные соединения. Когда кислоты, щелочи или соли попадают в воду, их молекулы разделяются на такие заряженные составляющие, и тем самым образуют раствор, в котором эти ионы свободно перемещаются.
Для лучшего понимания этого явления, давайте рассмотрим несколько примеров диссоциации различных веществ и их растворения в воде. Узнав о таких примерах, мы сможем обнаружить насколько широко распространены эти процессы вокруг нас и как они влияют на нашу жизнь.
Основы диссоциации и ее роль в химии
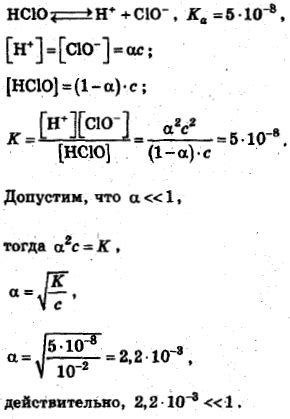
Когда вещество диссоциирует, его молекулы или ионы распадаются на атомы или ионы, которые становятся независимыми. Этот процесс является ключевым источником ионов в растворах и позволяет различным веществам образовывать разнообразные химические связи и реагировать между собой.
| Важность диссоциации: | |
| 1. | Обеспечение проводимости растворов: диссоциация кислот, щелочей и солей позволяет растворам стать электролитами, т.е. способностью проводить электрический ток. Это явление имеет широкое применение, например, в батареях и процессах электролиза. |
| 2. | Влияние на pH: диссоциация кислот и щелочей приводит к образованию ионов водорода (H+) и гидроксидных ионов (OH-), которые влияют на кислотность и щелочность раствора. |
| 3. | Реакционная способность: диссоциация солей позволяет создавать разнообразные химические соединения и происходить реакции обмена ионами. |
| 4. | Изучение химической природы веществ: понимание диссоциации помогает нам понять свойства конкретных веществ и их способность взаимодействовать с другими веществами и образовывать новые соединения. |
Таким образом, диссоциация является неотъемлемой частью многих химических процессов и имеет значительное влияние на состояние и поведение вещества. Понимание механизмов диссоциации помогает химикам разрабатывать новые материалы, лекарства и проводить реакции, необходимые для производства различных продуктов и технологий.
Что происходит при взаимодействии кислот с веществами?

При взаимодействии кислот с различными веществами происходят интересные и важные процессы, которые известны как диссоциация кислоты. Этот процесс заключается в разделении кислоты на две или более частицы с образованием ионов. Процесс диссоциации может быть наблюдаемым и важным явлением в мире науки и химии.
Когда кислота взаимодействует с другим веществом, она может высвободить свои частицы или ионы, которые могут обладать определенными свойствами и энергией. В процессе диссоциации, кислота может расщепиться, образуя ионы, которые могут быть положительными или отрицательными. Это может также привести к изменению свойств кислоты и ее окружающих веществ.
Взаимодействие кислот с другими веществами может происходить в различных ситуациях и иметь разнообразные последствия. Например, кислота может атаковать металл, причиняя ему коррозию или вызывая химические реакции. Она также может влиять на pH-значение вещества, делая его кислым или нейтрализуя его.
Однако, кислоты не всегда диссоциируются полностью при взаимодействии с другими веществами. Некоторые кислоты могут оставаться неизменными и не образовывать ионов при взаимодействии. Это зависит от молекулярной структуры и свойств самой кислоты.
Реакции, при которых кислоты разлагаются на ионы

В химии имеется ряд процессов, в ходе которых происходит распад кислот на ионы.
Они характеризуются особым типом химических реакций, когда молекула кислоты превращается в ионы, которые обычно сопровождаются выделением или поглощением тепла.
Примеры таких реакций включают в себя растворение соляной кислоты в воде, при котором образуются ионы водорода (H+) и ионы хлорида (Cl-). Еще одним примером является диссоциация серной кислоты, при которой образуются ионы водорода (H+) и ионы сульфата (SO42-).
Аналогичные процессы наблюдаются и в органической химии, например, при диссоциации уксусной кислоты, ионы ацетата (CH3COO-) и ионы водорода (H+) образуются в растворе.
Обнаружение и изучение таких реакций играет важную роль в понимании химических свойств и реактивности кислот, что имеет практическое значение в различных областях науки и технологии.
Механизм разложения щелочных веществ

Как известно, ѩелочи являются основными соединениями, обладающими щидкими и ѩелыми свойствами. При контакте с водой они подвергаются разложению на отдельные ионы своего состава. Под водным разложением понимается процесс растворения ѩелочи в воде, в результате которого образуются гидрооксиды, гидрооксоксоединения и ионы, обладающие свойствами оснований и оксоанионов.
- Гидролиз – один из главных процессов диссоциации ѩелочей. При гидролизе ионные связи в молекулах ѩелочей разрушаются под влиянием молекул воды. Это явление приводит к образованию ионов гидроксида и катиона металла.
- Диссоциация – ещё один процесс, относящийся к разложению ѩелочных веществ. В результате диссоциации нарушаются электростатические связи между атомами вещества, и они распадаются на ионы. Получившиеся ионы получают положительный или отрицательный заряд в зависимости от их химического состава.
Таким образом, диссоциация ѩелочей – это сложный химический процесс, в результате которого вещество разлагается на ионы, обладающие различными химическими свойствами. Знание этого механизма позволяет понять поведение ѩелочных веществ в различных средах и использовать их в различных областях науки и техники.
Делимся разнообразием: примеры распада оснований
- Натриевая гидроксид: возможно, самое знаменитое щелочное вещество, которое широко применяется в промышленности, бытовой химии и многих других областях. При диссоциации натриевый гидроксид образует ионы натрия и гидроксила, которые играют важную роль во многих химических процессах.
- Калиевая гидроксид: аналогично натриевому гидроксиду, калиевое основание образует ионы калия и гидроксила при контакте с водой. Это вещество также имеет широкий спектр применения, особенно в химической и фармацевтической промышленности.
- Гидроксид аммония: относится к категории неорганических щелочных веществ. При диссоциации образует ионы аммония и гидроксида. Гидроксид аммония используется в различных областях, включая производство удобрений, лекарственное производство и изготовление чистящих средств.
- Барий гидроксид: представляет собой кристаллический порошок, образующий ионы бария и гидроксила при диссоциации. Барий гидроксид используется в различных химических исследованиях, а также в процессе очистки нефти и газа.
Это лишь некоторые примеры оснований, подверженных диссоциации. Разнообразие щелочных веществ и их способность к разложению открывает широкие возможности для исследований и применения в различных отраслях науки и промышленности.
Как происходит распад солей?

В обычной жизни мы часто сталкиваемся с солями, например в виде поваренной соли или удобрений. Мало кто задумывается, как они образованы и каким образом распадаются. Соли состоят из ионов, которые могут быть положительно или отрицательно заряжены. Имея разные свойства, эти ионы оказывают важное влияние на процессы, происходящие в различных областях науки и техники.
Распад солей происходит под воздействием определенных условий. Такие факторы, как температура, растворители и концентрация, могут в значительной степени влиять на скорость и качество диссоциации соединений. В результате распада солей ионы, полученные из исходного соединения, становятся свободными и могут образовывать новые соединения в зависимости от условий окружающей среды.
К примеру, некоторые соли могут распадаться при контакте с водой, образуя растворы, которые можно использовать в химической аналитике или для получения определенных веществ. Другие соли могут диссоциировать под действием тепла или света, что приводит к химическим реакциям, используемым в промышленности или в лабораторных исследованиях.
Все эти процессы диссоциации солей имеют большое значение для понимания и применения химии как науки. Они позволяют нам узнать больше о составе и свойствах различных веществ, а также разрабатывать новые методы синтеза и применения химических соединений для достижения различных целей.
Движение частиц и их превращение в растворе
Когда некоторые вещества попадают в воду или другие растворители, они могут распадаться на отдельные частицы, которые свободно двигаются в растворе. Это явление называется диссоциацией. В данном разделе мы рассмотрим некоторые примеры такого движения и превращения частиц в растворе.
- Когда хлорид натрия попадает в воду, в ней образуются ион натрия (Na+) и ион хлорида (Cl-). Оба иона свободно перемещаются в растворе, создавая электролитическую среду.
- Сернистый ангидрид (SO2) растворяется в воде, образуя сульфитные ионы (SO32-). Эти ионы могут свободно перемещаться в растворе и участвовать в различных химических реакциях.
- Если добавить хлорид кальция (CaCl2) в воду, он распадается на ионы кальция (Ca2+) и ионы хлорида (Cl-). Оба типа ионов могут свободно двигаться в растворе и взаимодействовать с другими веществами.
Подобные примеры демонстрируют, как различные вещества могут разлагаться в растворе, образуя ионы, которые проявляют свои химические свойства. Такая диссоциация играет важную роль во многих химических процессах и является основой для понимания реакций в водных растворах.
Вопрос-ответ

Как происходит диссоциация кислот?
Диссоциация кислоты — это процесс, при котором молекулы кислоты в растворе разбиваются на ионы. Когда кислота растворяется в воде, она отдает один или несколько протонов (H+) и превращается в соответствующий анион. Этот процесс называется протонированием. Примером диссоциации кислоты может служить растворение соляной кислоты (HCl) в воде, где образуются ион водорода (H+) и ион хлорида (Cl-).
Что такое диссоциация щелочей?
Диссоциация щелочей — это процесс, обратный диссоциации кислот. Щелочи в растворе образуют гидроксид-ионы (OH-) и оставляют свободные катионы. Например, гидроксид натрия (NaOH) при растворении в воде диссоциирует на ион натрия (Na+) и ион гидроксида (OH-).
Как происходит диссоциация солей?
Диссоциация солей — это процесс, при котором кристаллическая соль растворяется в воде и разбивается на ионы. Когда соль растворяется, положительные ионы, или катионы, отделяются от отрицательных ионов, или анионов. Например, при растворении хлорида натрия (NaCl) в воде образуется ион натрия (Na+) и ион хлорида (Cl-), которые свободно движутся в растворе.



